
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固溶体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。
(1)基态钴原子的价电子排布图为___________。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体(如下图)。科学研究表明,顺式分子具有抗癌活性。

①吡啶分子是大体积平面配体,其结构简式如图所示![]() 。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
。每个吡啶分子中含有的σ键数目为___________。吡啶分子中所含的各元素的电负性由大到小的顺序是___________。
②二氯二吡啶合铂中存在的微粒间作用力有___________(填字母)。
a.范德华力 b.氢键 c.金属键 d.非极性键
③反式二氯二吡啶合铂分子是___________(填“极性分子”或“非极性分子”)。

(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如下图所示。
①“分子金属”可以导电,是因为___________能沿着其中的金属原子链流动。
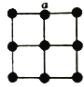
②“分子金属”中,铂原子是否以sp3的方式杂化?_________(填“是”或“否”),其理由是_______。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=______nm(列计算式)。
【答案】![]() 11 N>Cl>C ad 非极性分子 电子 否 若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构
11 N>Cl>C ad 非极性分子 电子 否 若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构 ![]() (或
(或![]() )
)
【解析】
(1)钴为27号元素,价电子排布为3d74s2,则基态钴原子的价电子排布图为![]() ;
;
(2)①吡啶环上的原子形成6个![]() 键,还有5个C-H
键,还有5个C-H![]() 键,故每个吡啶分子中含有的
键,故每个吡啶分子中含有的![]() 键数目为11;
键数目为11;
同一周期主族元素从左到右第一电离能有增大的趋势,但由于氮原子核外p轨道处于半充满状态,第一电离能相对较高,故C、N、Cl三种元素的第一电离能由大到小的顺序是N>Cl>C;
②二氯二吡啶合铂为分子晶体,故含有范德华力;二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,Pt2+、与2个Cl-、吡啶形成配位键,没有离子键,吡啶中碳原子之间形成极性键、不同原子之间形成非极性键,C-H键中氢原子不能形成氢键,也没有金属键,故选ad项。
③反式二氯二吡啶合铂分子结构式为: 其结构对称,是非极性分子。
其结构对称,是非极性分子。
(3)①金属中不含阴阳离子,其能导电是因为电子定向移动形成电流;
②该分子为平面型的铂配合物分子,铂原子轨道不能sp3杂化。
(4)金属铂晶体中,铂原子的配位数为12,为立方晶胞,结合沿x、y或z轴的投影图,可知铂为面心立方最密堆积,Pt原子处于顶点、面心,晶胞中Pt原子数目=8![]() +6
+6![]() =4,则
=4,则![]() =d g·cm-3
=d g·cm-3![]() ,解得a=
,解得a=![]() (或
(或![]() )。
)。
(1)钴为27号元素,价电子排布为3d74s2,则基态钴原子的价电子排布图为![]() ;
;
故答案为:![]() ;
;
(2)①吡啶环上的原子形成6个![]() 键,还有5个C-H
键,还有5个C-H![]() 键,故每个吡啶分子中含有的
键,故每个吡啶分子中含有的![]() 键数目为11;
键数目为11;
同一周期主族元素从左到右第一电离能有增大的趋势,但由于氮原子核外p轨道处于半充满状态,第一电离能相对较高,故C、N、Cl三种元素的第一电离能由大到小的顺序是N>Cl>C;
②二氯二吡啶合铂为分子晶体,故含有范德华力;二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,Pt2+、与2个Cl-、吡啶形成配位键没有离子键,吡啶中碳原子之间形成极性键、不同原子之间形成非极性键,C-H键中氢原子不能形成氢键,也没有金属键,故选ad项。
③反式二氯二吡啶合铂分子结构式为: 其结构对称,是非极性分子。
其结构对称,是非极性分子。
故答案为:11;N>Cl>C;ad;非极性分子;
(3)①分子金属中不含自由移动的阴、阳离子,其能导电是因为有自由电子能沿着其中的金属原子链流动,电子定向移动形成电流;
②该分子为平面型的铂配合物分子,铂原子轨道不能sp3杂化,若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构;
故答案为:电子;否;若铂原子轨道为sp3杂化,则该分子结构为四面体,非平面结构;
(4)金属铂晶体中,铂原子的配位数为12,为立方晶胞,结合沿x、y或z轴的投影图,可知铂为面心立方最密堆积,Pt原子处于顶点、面心,晶胞中Pt原子数目=8![]() +6
+6![]() =4,则晶胞的质量为
=4,则晶胞的质量为![]() =d g·cm-3
=d g·cm-3![]() ,解得a=
,解得a=![]() (或
(或![]() )。
)。


科目:高中化学 来源: 题型:
【题目】下列关于过滤和蒸发说法中不正确的是( )
A. 过滤是从液体中分离出难溶物质的实验方法
B. 蒸发是减少溶剂,让溶质析出的实验方法
C. 过滤和蒸发实验中都用到的玻璃仪器是铁架台
D. 加热蒸发可以使溶液浓缩或溶质结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海水为电解质的Mg-AgCl电池在军事上可用作电动鱼雷的电源,其电池反应离子方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。该电池工作时,下列说法正确的是

A. 正、负极的质量均减少 B. AgCl电极发生氧化反应
C. 电子由AgCl经外电路流向Mg D. 实现了电能向化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中Br2可氧化二氧化硫:Br2+SO2+2H2O→2HBr+H2SO4,如图是有关二氧化硫性质的实验装置图,试回答下列问题:

(1)写出实验室制SO2的化学方程式:____。
(2)二氧化硫具有:①漂白性 ②酸性氧化物的性质 ③还原性 ④氧化性,在上图几个装置中对应表现出的性质是(填序号):
A中___B中____C中___D中____
(3)有四位同学设计下列四个方案检验E溶液中是否含有SO42-,你认为合理的是(_____)
A.试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解
沉淀不溶解
B.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
C.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
D.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
(4)实验完毕后,将B中溶液取少量于试管中加热,现象是___,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
2SO3(g),达到平衡时SO3为0.3 mol,此时若移走0.5 mol O2和0.5 mol SO2,相同温度下再次达到新平衡时SO3的物质的量为
A. 0.3 mol B. 0.15 mol
C. 小于0.15 mol D. 大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是( )

A.CH3COOH溶液中滴加KOH溶液
B.NaOH溶液中滴加稀HCl
C.Ba(OH)2溶液中滴加稀H2SO4
D.Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b为弹餐夹,其他装置略去)
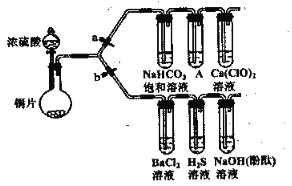
I验证SO2具有氧化性、还原性和酸性氧化物的通性。
(1) 连接仪器、检查装置气密性、加药品后,打开b (关闭a),然后滴入浓硫酸,加热。装有浓硫酸的仪器名称是___________,铜与浓硫酸反应的化学方程式是___________ 。
(2) 能验证SO2具有氧化性的实验现象是__________________________________________。
(3) 装有BaCl2溶液的试管中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀的化学式分别是___________,___________。写出其中SO2显示还原性并生成白色沉淀的总的离子方程式____________________________________________。
(4) 能验证SO2具有酸性氧化物的通性的实验现象是________________________________, 若通入过量的SO2,其化学方程式是____________________________________________。
II验证酸性的相对强弱:碳酸>次氯酸。(已知酸性:亚硫酸>碳酸)
(5) 打开a关闭b。装置A中的足量的试剂是___________。利用该装置能否判断碳酸的酸性比次氯酸强,理由是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是

A. H3AsO4溶液pKa2为4.5
B. NaH2AsO4溶液显碱性
C. 常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L
D. n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四种基本反应类型但属于氧化还原反应的是
A.2FeCl3+Cu=2FeCl2+CuCl2
B.CuSO4+H2S=CuS↓+H2SO4
C.Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com