
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
【答案】C
【解析】A、因由粗盐得到精盐,就是要除去粗盐中的杂质,除去Mg2+、CO32-、SO42-分别用NaOH溶液、盐酸、BaCl2溶液,这些反应都是化学反应,不是物理过程,A错误;B、因MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl26H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,B错误;C、因 Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,因此生产中需解决其对设备的腐蚀问题,C正确;D、工业上采用向母液中加入石灰乳的方法获得氢氧化镁,烧碱价格高,不划算,D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是
A. 热稳定性:HF>HCl>HBr
B. 原子半径:Na>S>O
C. 酸性:H3PO4>H2SO4>HClO4
D. 元素金属性:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。
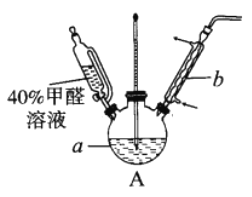
①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。
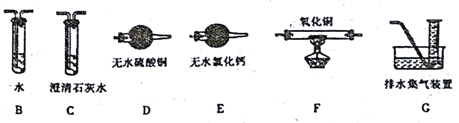
依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):
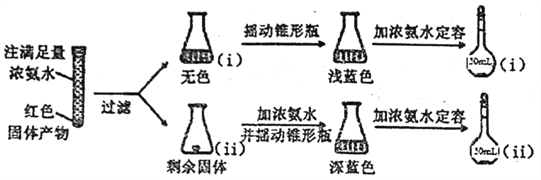
已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和氯气以物质的量1:1混合,在光照条件下,得到的产物是
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 ⑤HCl
A.只有①⑤ B.①②③④的混合物
C.只有②⑤ D.①②③④⑤的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是

A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是
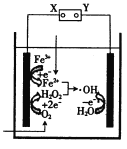
A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式___________。
(4)完成以下氧化还原反应的离子方程式:
(______)MnO4-+(______)C2O42-+______=(______)Mn2++(______)CO2↑+________。
Ⅱ.SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如图:
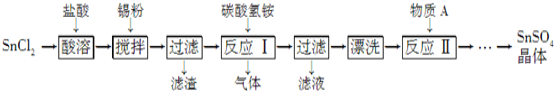
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+;SnCl2能水解生成碱式氯化亚锡。
(1)写出物质A的名称:_____。
(2)SnCl2用盐酸而不用水溶解的原因是___________(用化学方程式表示)。
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: _________。
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:___________________。 该反应的温度需要控制在75 ℃左右的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键也含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com