
����Ŀ�������仯�����ڹ�ũҵ����������������ҪӦ�ã����ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
��1����֪:N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) ��H=-393.5kJ/mol
2C(s)+O2(g)=2CO(g) ��H=-221kJ/mol
��ij��Ӧ��ƽ�ⳣ������ʽΪ��k=[c(N2)��c2(CO2)]/[c2(NO)��c(CO)2]����д���˷�Ӧ���Ȼ�ѧ����ʽ��___________��
��2��N2O5 ��һ�������¿ɷ����ֽ�:2N2O5��g��=4NO2��g��+O2��g����ij�¶��º����ܱ������м���һ���� N2O5����� N2O5 Ũ����ʱ��ı仯���±�:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
�ٷ�Ӧ��ʼʱ��ϵѹǿΪ P0���� 2.00min ʱ��ϵѹǿΪ P1���� P1:P0=_________��2.00~5.00min ���� NO2 ��ʾ�ĸ÷�Ӧ��ƽ����Ӧ����Ϊ_________��
��һ���¶��£��ں����ܱ������г���һ���� N2O5 ���и÷�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����________������ĸ��ţ���
a.NO2 �� O2 ��Ũ�ȱȱ��ֲ��� b.������ѹǿ���ٱ仯
c.2v ����NO2��=v ����N2O5�� d.�����ƽ����Է�������Ϊ 43.2���ұ��ֲ���
��3��ƽ�ⳣ�� Kp ���÷�Ӧ��ϵ���������ʵķ�ѹ����ʾ�ģ�����K����ʽ��ƽ��Ũ����ƽ���ѹ���棬��ѹ=��ѹ �� ���ʵ�������������:p��NO2��=p����x��NO2��(x��ʾ��������ʵ�������)��
N2O4 �� NO2 ת�����Ȼ�ѧ����ʽΪN2O4(g)![]() 2NO2(g) ��H=+24.4kJ/mol
2NO2(g) ��H=+24.4kJ/mol
������Ӧ�У�����Ӧ���� v��=k����p��N2O4�����淴Ӧ����v��=k����p2��NO2��������k����k��Ϊ���ʳ������� Kp Ϊ_________���� k ����k ����ʾ����
��4����ͼ���ܱշ�Ӧ���а� n��N2��:n��H2��=1:3 Ͷ�Ϻ��� 200�桢400�桢600���£��ϳ� NH3 ��Ӧ�ﵽƽ��ʱ��������� NH3 �����ʵ���������ѹǿ�ı仯���ߣ���֪�÷�ӦΪ���ȷ�Ӧ��

������ a ��Ӧ���¶���________��
��M ���Ӧ�� H2 ��ת������___________��
��5����ҵ�ϳ��ð�ˮ���ն����������ɣ�NH4��2SO3��ͨ�������ж���NH4��2SO2 ��Һ�������________����д��������̣����ü�Ҫ�����ּ���˵��������֪����ˮKb=1.8��10-5��H2SO3��Ka1=1.3��10-2 Ka2=6.3��10-8��
���𰸡� 2NO(g)+2CO(g)![]() N2(g)+2CO(g)��H=-746.5kJ/mol 7:4 0.22mol.L-1.min-1 b k��/k��
N2(g)+2CO(g)��H=-746.5kJ/mol 7:4 0.22mol.L-1.min-1 b k��/k��![]() 200�� 75% �Լ��ԣ������ԣ�
200�� 75% �Լ��ԣ������ԣ�
��������(1)��ij��Ӧ��ƽ�ⳣ������ʽΪ��k=![]() ����ӦΪ2NO(g)+2CO(g)N2(g)+2CO2(g)����N2(g)+O2(g)=2NO(g)��H=+180.5kJmol-l����C(s)+O2(g)=CO2(g)��H=-393.5kJmol-l����2C(s)+O2(g)=2CO(g)��H=-221kJmol-l����˹���ɼ������2-��-�ٵõ�2NO(g)+2CO(g)N2(g)+2CO2(g)��H=-746.5kJmol��1���ʴ�Ϊ��2NO(g)+2CO(g)N2(g)+2CO2(g)��H=-746.5kJmol��1��
����ӦΪ2NO(g)+2CO(g)N2(g)+2CO2(g)����N2(g)+O2(g)=2NO(g)��H=+180.5kJmol-l����C(s)+O2(g)=CO2(g)��H=-393.5kJmol-l����2C(s)+O2(g)=2CO(g)��H=-221kJmol-l����˹���ɼ������2-��-�ٵõ�2NO(g)+2CO(g)N2(g)+2CO2(g)��H=-746.5kJmol��1���ʴ�Ϊ��2NO(g)+2CO(g)N2(g)+2CO2(g)��H=-746.5kJmol��1��
(2)����ͬ�����£���������ʵ���֮�ȵ�����ѹǿ֮�ȣ�
2N2O5(g)�T4NO2(g)+O2(g)
��ʼ(mol/L)1.00 0 0
��Ӧ(mol/L)0.501.00 0.25
2min(mol/L)0.50 1.00 0.25
��Ӧǰ�������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����p1��p0=(0.5+1.0+0.25)mol��1.00mol=![]() ��2.00min��5.00min�ڣ�v(N2O5)=
��2.00min��5.00min�ڣ�v(N2O5)=![]() mol/(L��min)=0.11mol/(L��min)���ٸ���ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȵ�NO2�ķ�Ӧ����=2v(N2O5)=0.22molL-1min-1���ʴ�Ϊ��=
mol/(L��min)=0.11mol/(L��min)���ٸ���ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȵ�NO2�ķ�Ӧ����=2v(N2O5)=0.22molL-1min-1���ʴ�Ϊ��=![]() ��0.22molL��1min��1��
��0.22molL��1min��1��
��a��NO2��O2��Ũ�ȱ�ʼ�ն����䣬����ȷ����Ӧ�Ƿ�ﵽ��ѧƽ��״̬����a����b��������ѹǿ���ٱ仯����Ӧ�Ѵﵽ��ѧƽ��״̬����b��ȷ��c������(NO2)=2����(N2O5)�ű�ʾ���淴Ӧ������ȣ����2v ��(NO2)=v ��(N2O5)��˵������ƽ��״̬����c����d�����ݷ���ʽNO2(g)��O2(g)�Ļ�������ƽ����Է�������Ϊ![]() =43.2��ƽ��ʱ������N2O5�������ƽ����Է�����������43.2���ұ��ֲ��䣬��d���ʴ�Ϊ��b��
=43.2��ƽ��ʱ������N2O5�������ƽ����Է�����������43.2���ұ��ֲ��䣬��d���ʴ�Ϊ��b��
(3)ƽ��ʱ����������ȣ���v��=k����p(N2O4)��v��=k����p2(NO2)�������ɵ�Kp=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)�ٺϳɰ��ķ�ӦΪ���ȷ�Ӧ����Ӧ�¶�Խ�ߣ�Խ�����ڷ�Ӧ�Ľ��У�����a�İ��������ʵ���������ߣ��䷴Ӧ�¶ȶ�Ӧ�����ͣ�����a���߶�Ӧ�¶�Ϊ200��C���ʴ�Ϊ��200��C��
����M�㰱�������ʵ���Ϊ60%��ʣ��40%����Ϊ��Ӧ���а�n(N2)��n(H2)=1��3Ͷ�ϣ���ʣ���������ʵ���Ϊ30%����ΪN2(g)+3H2(g)2NH3(g)����������Ӧ���������ʵ���90%������M���Ӧ������ת����=![]() ��100%=75%���ʴ�Ϊ��75%��
��100%=75%���ʴ�Ϊ��75%��
(5)笠����ӵ�ˮ��ƽ�ⳣ��=![]() =
=![]() =
=![]() ����10-9������������ӵĵ�һ��ˮ��ƽ�ⳣ��=
����10-9������������ӵĵ�һ��ˮ��ƽ�ⳣ��=![]() =
=![]() =
=![]() ����10-6������������ӵ�ˮ��̶ȴ���笠����ӣ���Һ�Լ��ԣ��ʴ�Ϊ���Լ�����
����10-6������������ӵ�ˮ��̶ȴ���笠����ӣ���Һ�Լ��ԣ��ʴ�Ϊ���Լ�����


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к͵ζ�ʵ���õ��������У�ֻ��������ˮϴ�������ô�ʢ��Һ����ϴ����(����)
A. ��ʽ�ζ��� B. ��ʽ�ζ��� C. �ձ� D. ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�![]() ��R-�������·�Ӧ
��R-�������·�Ӧ![]() +5R-+6H+��3R2+3H2O�������й�RԪ�ص�������ȷ���ǣ� ��
+5R-+6H+��3R2+3H2O�������й�RԪ�ص�������ȷ���ǣ� ��
A. R�ǵ���A��Ԫ�� B. R2�ڳ�����һ��������
C. ![]() �е�RԪ��ֻ�ܱ���ԭ D. R���⻯���ˮ��Һ��ǿ��
�е�RԪ��ֻ�ܱ���ԭ D. R���⻯���ˮ��Һ��ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��� 10mL 0.1mol/ LCuCl2 ��Һ�еμ� 0.1mol/L �� Na2S ��Һ���μӹ����У���Һ��-lgc��Cu2+���� Na2S ��Һ�����V���Ĺ�ϵ������ͼ��ʾ����֪:lg2=0.3��Ksp��ZnS��=3��10��25mo/L2�������й�˵������ȷ����
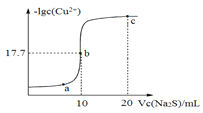
A. a��b��c �����У�ˮ�ĵ���̶�����Ϊ b ��
B. Na2S ��Һ��:2��c��S2����+c��HS����+c��H2S����=c��Na+��
C. ���¶��� Ksp��CuS��=4��10��36mol2/L2
D. �� 100mLZn2+��Cu2+Ũ�Ⱦ�Ϊ10��5mol/L �Ļ����Һ����μ���10��4mol/L �� Na2S��Һ��Cu2+�ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܼ�����������̼��������һ����Ҫ���������ν�CO2ת��Ϊ�����õ���Դ��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���һ�������·�����Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����ͼ��ʾ�÷�Ӧ����������(��λΪkJ��mol��1)�ı仯��ͼ�����ڸ÷�Ӧ������˵���У���ȷ����(����)
CH3OH(g)��H2O(g)����ͼ��ʾ�÷�Ӧ����������(��λΪkJ��mol��1)�ı仯��ͼ�����ڸ÷�Ӧ������˵���У���ȷ����(����)

A. ��H>0����S>0 B. ��H>0����S<0
C. ��H<0����S<0 D. ��H<0����S>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ�����ʴ�����������������ǣ� ��
A. �����Ŀ���ʴ�����ȴ�����
B. �������ӵ��������������Ӵ�������
C. ����բ����ֱ����Դ�����������ɷ�ֹ�䱻��ʴ
D. �ִ�����ں�ˮ����ʴ����Ҫԭ���Ƿ���������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ڻ�ѧԪ�ص������������
A. ͬһ�����岻ͬ��֯ϸ���ڻ�ѧԪ������ͺ���������ͬ
B. C��H��O��N�����������Ļ���Ԫ��
C. �������е�SԪ�ش����ڰ������R����
D. Fe��Ȼ����Ԫ�أ����Dz���Ѫ�쵰�ĺϳɣ������������Ҫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C8H18���ಽ�ѻ��������ȫת��ΪC4H8��C3H6��C2H4��C2H6��CH4��������Ļ����û�����ƽ����Է������������ǣ�������
A.28
B.30
C.38
D.40
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У���Һ��pH����7����
A. ��NaCl��Һ�еμӴ��� B. ��KNO3��Һ�еμ�ϡH2SO4
C. ��ϡHCl��Һ�еμ�ϡHNO3 D. ��NaOH��Һ�еμ�Na2CO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com