

| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、物质的量是一个基本物理量,表示物质所含粒子的多少 |
| B、1mol氢中含有2mol氢原子和2mol电子 |
| C、1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) |
| D、摩尔表示物质的量的数量单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
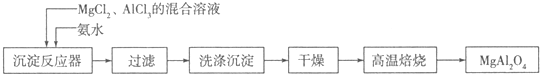
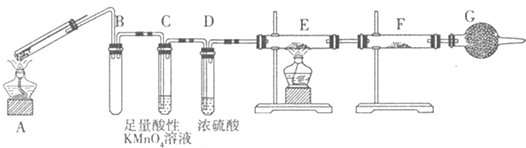
查看答案和解析>>
科目:高中化学 来源: 题型:
 所含官能团的名称是
所含官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
有两种位于短周期的相邻周期、相邻主族的非金属元素X、Y,已知两元素最高价氧化物的水化物均为强酸.根据如图转化关系(反应条件及部分产物已略去),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求完成下列问题:
按要求完成下列问题: ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子方程式 | 结论 |
| A | AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | 溶解度:AgI>AgCl |
| B | Fe2++H2O2+2H+═Fe3++2H2O | 氧化性:H2O2>Fe3+ |
| C | CO32-+CO2+H2O═2HCO3- | 稳定性:HCO3->CO32- |
| D | NH3+H3O+═NH4++H2O | 得质子能力:NH3>H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与水反应Cl2+H20═2H++Cl-+ClO- |
| B、将铝粉投入氧氧化钠离溶液中:2Al+20H-═2AlO2-+H2↑ |
| C、金属钠与水反应:2Na+2H20═2Na++20H-+H2↑ |
| D、氯化铝溶液与过量氨水反应Al3++4NH3?H2O═Al02-+4NH4++2H20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com