
 所含官能团的名称是
所含官能团的名称是 ,
, ;
;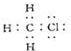 ,故答案为:
,故答案为: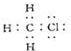 ;
;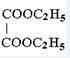 ,故答案为:
,故答案为: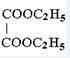 ;
;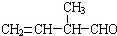 的官能团名称是碳碳双键、醛基,该有机物发生加聚反应后,所得产物的结构简式为
的官能团名称是碳碳双键、醛基,该有机物发生加聚反应后,所得产物的结构简式为 ,
, .
.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| A、Si 和H2SO4 |
| B、Na和MgCl2 |
| C、CaC2和CuSO4 |
| D、Na2O和NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率[×10-3 mol?(L?min)-1] | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向铁粉中加入足量稀硝酸:2Fe+6H+═2Fe3++3H2↑ |
| B、向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O |
| C、向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-═I-+3SO42-+3H+ |
| D、向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com