
����Ŀ����ѧ����������һ������ʽ��ﮡ�������أ�����ʱ���տ����е������ڶ���Ƴɵ����������Ϸ�Ӧ���ܷ�Ӧ�ɱ�ʾΪ2Li��O2![]() Li2O2�����й�˵����ȷ����
Li2O2�����й�˵����ȷ����
A�����ʱ������Ƴɵĵ缫��ӵ�Դ����
B���ŵ�ʱ��Li���Ӹ����������ƶ�
C���ŵ�ʱ�����տ�����22.4 L��O2������2 mol e���ӵ�ظ�������
D���õ�ؿ�ʹ�ú�Li����ˮ��Һ���������Һ
���𰸡�B
��������
���������A�����ʱ��Li2O2����Ԫ��ʧ�����������������Զ���Ƴɵĵ缫������������ӵ�Դ��������������A����B���ŵ�ʱ���������������ƶ�������Li+�Ӹ����������ƶ�����B��ȷ��C��û˵���DZ�״�������������ʵ��������㣬���Բ��ܼ��㸺��ʧȥ�ĵ���������C����D���õ�صĸ�������ΪLi������ˮ��Ӧ�����Ըõ�ز���ʹ�ú�Li+��ˮ��Һ���������Һ����D������ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ũ�����˵����ȷ����
A. ������ˮ�� B. �ܶȱ�ˮС
C. �ɸ���NH3 D. ����ʱ��ͭ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�к�������HCl���壬Ҫ���ȥHCl���壬���ѡ�ã� ��
A. ����Na2CO3��Һ B. ����ʯ��ˮ
C. ����NaHCO3��Һ D. Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¶��£������Ϊ1L�����������ܱ������з������淴Ӧ��N2��g��+3H2��g��![]() 2NH3��g�� ��H= -92.6 kJ / mol������������±���
2NH3��g�� ��H= -92.6 kJ / mol������������±���
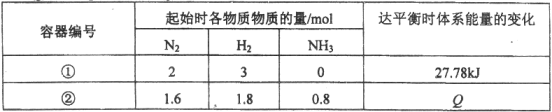
������������ȷ����
A���������з�Ӧ��ʼʱv������> v������
B�������������з�Ӧ��ƽ��ʱѹǿ���
C���������з�Ӧ��ƽ��ʱ�����յ�����QΪ9.26 kJ
D��������Ϊ�����Ⱥ��������������з�Ӧ��ƽ��ʱn ��NH3��< 0.6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѡ��5�����л���ѧ�������ı�����ϩ(TPE)������������оۼ��յ��������ԣ��ڹ����ϵ�����Ӧ��ǰ��������������TPE�������ϳ�·��(�����Լ�����Ӧ����ʡ��)��
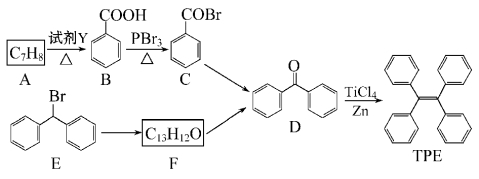
(1)A�������� ���Լ�YΪ ��
(2)B��C�ķ�Ӧ����Ϊ ��B�й����ŵ������� ��
D�ĺ˴Ź���������_______���塣
(3)E��F�Ļ�ѧ����ʽ�� ��
(4)W��D��ͬ���칹�壬�������нṹ��������������(![]() )��һԪȡ����ڴ����Ǽ�(��CH2OH)��д��W���п��ܵĽṹ��ʽ�� ��
)��һԪȡ����ڴ����Ǽ�(��CH2OH)��д��W���п��ܵĽṹ��ʽ�� ��
(5)����˵����ȷ���� ��
a. B�����Աȱ���ǿ b. D���ܷ�����ԭ��Ӧ
c. E����4�ֲ�ͬ��ѧ�������� d. TPE����̼ԭ��һ����ƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaHSO4��ˮ��Һ���ܹ������H+��Na+��SO42-�����ж���NaHSO4�ķ����в���ȷ����
A. ������ B. ��ʽ�� C. ���� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��鶼�������г�������������������ͬһ�����ʵ�һ����
A. ���ס�ҽ�þƾ������� B. ���顢�ӵ��Ρ�ʯ��ˮ
C. ʳ�ס�Һ�������� D. ��ˮ����Ȼ����ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������˫��ˮ��ҽ������������ɱ����������������ϴ�˿ڡ���ʱ����Ϊ��ҵ��Һ���������С���ɫ�������������ơ�
��1����ƽ���л�ѧ��Ӧ�����õ����ű�ʾ����ת�Ƶķ������Ŀ������ƽ�͵����Ÿ�ռ������
[ ]H2O2+[ ]Cr2(SO4)3+[ ]KOH��[ ]K2CrO4+[ ]K2SO4+[ ]H2O
��2���������ɿ�ҵ��Һ�е��軯���KCN��CΪ+2�ۣ��������·�Ӧʵ�֣�KCN+H2O2+H2O=A+NH3����
��ָ��A�Ļ�ѧʽ ����˷�Ӧ����6.72L����״�����������ɣ�ת�Ƶ�����ĿΪ ����NA��ʾ����
��3���������Ҳ������ҽѧɱ�����������ݷ�Ӧ�������ж�������������������ǿ����������
MnO2+4HCl(Ũ)![]() MnCl2+C12��+2H2O��
MnCl2+C12��+2H2O��
2KMnO4+16HCl(Ũ)=2MnCl2+5C12��+8H2O��
��Mn02��KMnO4������ ǿ��
ijǿ�ᷴӦ��ϵ�У���Ӧ��������ﹲ�������ʻ����ӣ�O2��MnO4-��H2O��Mn2+��H2O2��H+����֪�÷�Ӧ��H2O2 ֻ���������¹��̣�H2O2��O2����÷�Ӧ�з�����ԭ��Ӧ�Ĺ����ǣ�_________��_________���÷�ӦӦѡ������ǣ�_________������ţ���
A������ B��Ũ���� C��ϡ���� D������
��4����0.2 mol/L Na2SO3��Һ32 mL����ԭ��4��10��3 mol XO42������Һ��������Na2SO3��0.2mol/L KMnO4������Һ����(����KMnO4����ԭ��Mn2+)��������KMnO4��Һ0.8 mL����Ԫ��X�ڻ�ԭ�����еĻ��ϼ����� ��
A��+1 B��+2 C��+3 D��+4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com