
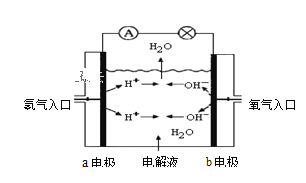
【题目】Ⅰ.下图为氢氧燃料电池原理示意图,按下图的提示,回答以下问题:
(1)若电解质溶液为KOH溶液,则写出电极反应式:![]() 极 ____________,
极 ____________,![]() 极 _______________。
极 _______________。
(2)若电解质溶液为稀H2SO4,则写出电极反应式:![]() 极 _____________,
极 _____________,![]() 极 _______________。
极 _______________。
Ⅱ.氨基甲酸铵分解反应为NH2COONH4(s) ![]() 2NH3(g)+CO2(g),在体积不变的密闭容器中发生反应,可以判断该反应已经达到平衡的是__________。
2NH3(g)+CO2(g),在体积不变的密闭容器中发生反应,可以判断该反应已经达到平衡的是__________。
A.密闭容器中氨气的体积分数不变 B.1molNH2COONH4分解同时有44gCO2消耗
C.密闭容器中混合气体的密度不变 D.![]()
【答案】2H2-4e-+4OH-=4H2O O2+2H2O+4e-=4OH- 2H2-4e-=4H+ O2+4e-+4H+ =2H2O BC
【解析】
Ⅰ电解质溶液的酸碱性不同,各电极的产物不同;
Ⅱ根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化。
Ⅰ(1)电解质溶液为碱性时,H2失电子生成的H+,再和碱性溶液中的OH-反应生成H2O,所以a极上发生的电极反应是H2失电子和OH-生成水,即电极反应式为2H2-4e-+4OH-=4H2O;b极上O2得电子和H2O生成OH-,所以其电极反应式为 O2+2H2O+4e-=4OH-;
(2) 电解质溶液为酸性时,H2失电子生成的H+,电解质溶液为酸,H+可以大量存在,因此a极上H2失电子后生成H+,反应式为:2H2-4e-=4H+;b极上O2得电子,和H+反应生成水,电极反应式为:O2+4H++4e-=2H2O;
Ⅱ当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化。
A.反应混合气体只有氨气与二氧化碳,二者物质的量之比始终为2:1,氨体积分数始终不变,因此不能说明到达平衡;A项错误;
B.1molNH2COONH4分解表示正反应该速率,44gCO2消耗,表示逆反应速率,44gCO2的物质的量为1mol,消耗的物质成计量数之比,说明正反应速率等于逆反应速率,反应达到平衡,B项正确;
C.随反应进行混合气体的质量增大,容器的容积不变,反应混合气体的密度增大,当密度不再变化,说明到达平衡状态,C项正确;
D.没有指明正、逆速率,不能判断是否到达平衡,D项错误;
本题答案选BC。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列各项中的物质均在标准状况下,有关判断正确的是( )
A. 16.8 L CH4和CO2的混合气体中含有的碳原子数为0.75NA
B. 4.6 g NO2和CH3CH2OH的混合物中含有的分子数为0.1NA
C. 5.6 L SO3中含有的电子数为30NA
D. 11.2 L氖气中含有的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A. CH3COOH溶液中加入少量CH3COONa固体,溶液的pH值升高
B. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)- c(CH3COOH)=2[c(H+)-c(OH-)]
C. 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/ c(H+)减小
D. 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
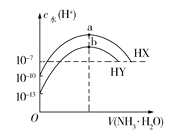
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题:
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为____________,该反应中Cu2O作_________(填“氧化剂”或“还原剂”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
(2)压强为p kPa时,同一体系中发生反应①和反应②,温度对二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡转化率的影响如图1所示,则ΔH1______0(填“>”或“<”,下同)、ΔH2______0。温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。
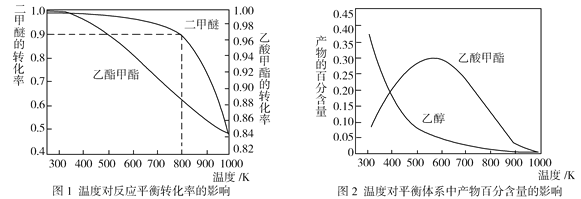
(3)若压强为p kPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3和1 mol CO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )

A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甘油酯GMA(![]() ),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如图(部分反应所需试剂和条件已略去):
),由于本身带有丙烯酸酯双键和环氧基团,使得其应用十分广泛。工业合成GMA的一种方法如图(部分反应所需试剂和条件已略去):
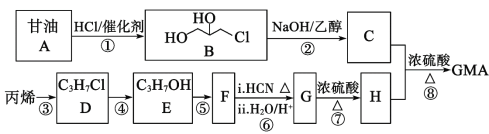
已知:
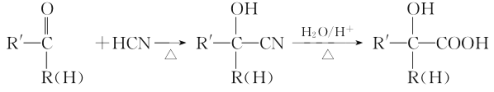
请按要求回答下列问题:
(1)B中的官能团名称:__;
(2)C的结构简式__;
(3)请写出E→F的反应方程式和反应类型:E→F:__,__反应;
(4)H的核磁共振氢谱峰面积之比由大到小为__,H的同分异构体中能发生水解反应的链状化合物有__种。
(5)已知:CH2=CH2![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:![]()
![]() __。
__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示:

下列对实验的叙述正确的是
A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应
B. 装置B 中盛放浓硫酸
C. 装置D 中的洗涤液应用煮沸过的蒸馏水
D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com