
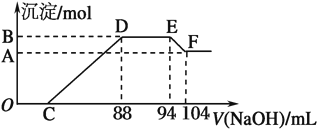
| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
| 0.24mol |
| 5mol/L |


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的硝酸和作氧化剂的硝酸质量比为2:1 |
| B、硝酸都用作氧化剂 |
| C、每个硝酸分子得到2个电子 |
| D、硝酸铜是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
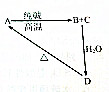 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
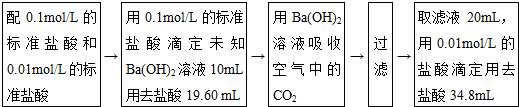
查看答案和解析>>
科目:高中化学 来源: 题型:
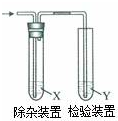 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓H2SO4共热至140℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓H2SO4共热至140℃ | NaOH溶液 | Br2的水溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com