
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
| 0.2×0.2 |
| 0.3 |
| ||||
|
| 1mol-0.4mol |
| 1mol |
| ||
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
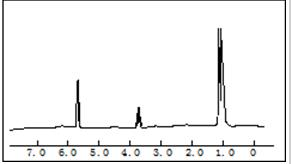 某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |  | |
| 甲 | AlCl3 | NaOH | NaAlO2 | AlCl3 | |
| 乙 | NaOH | AlCl3 | HCl | NH3?H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于查看答案和解析>>
科目:高中化学 来源: 题型:
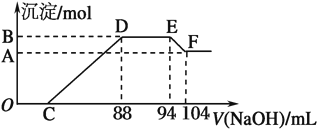
| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com