
 (1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于| m |
| M |
| n |
| V |
| 1.92g |
| 64g/mol |
| 0.03mol×2 |
| 3 |
| 0.03mol×8 |
| 3 |
| 0.08mol |
| 0.1L |
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①水 ②浓缩菠萝汁 ③蔗糖 ④黄原胶 ⑤维生素C ⑥柠檬黄 ⑦山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、他们都用HCl表示两者没有区别 |
| B、氯化氢和盐酸在潮湿的空气中都形成酸雾 |
| C、稀氯化氢和盐酸都能导电 |
| D、氯化氢是无色气体盐酸是无色溶液它们都有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
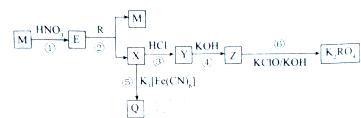
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
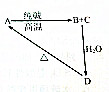 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水、浓H2SO4 |
| B、KMnO4酸性溶液、浓H2SO4 |
| C、溴水、浓H2SO4 |
| D、浓H2SO4、KMnO4酸性溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com