
| A、CaCl2溶液 |
| B、澄清石灰水 |
| C、稀盐酸 |
| D、pH试纸 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、含0.1mol?L-1 HCO3-的溶液中 NH4+、Na+、ClO-、C2H5OH |
| B、SO2的饱和溶液中,Ba2+,K+,NO3-、Cl- |
| C、c(OH-)/c(H+)=1×10-13的溶液中,K+、Ag+、NO3-、I- |
| D、加入酚酞试液是无色的溶液中,Mg2+、Fe3+、Br-、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验目的 | 实验室制取氨气 | 用图示的方法能检查此装置的气密性 | 证明硫的非金属性比硅强 | 证明非金属性Cl>C>Si |
| 装置及药品 | 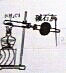 |  | 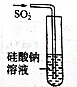 | 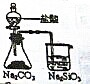 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在HCl气流中加热使之脱水 |
| B、在NH3气流中加热使之脱水 |
| C、加入P2O5固体加热使之脱水 |
| D、加入H2SO4加热使之脱水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为 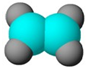 ③组成该有机物的两元素质量比为6:1 | ①由C、H两种元素组成 ②球棍模型为 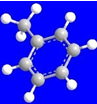 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与D反应生成相对分子质量为130的酯F | ①由C、H、O三种元素组成 ②球棍模型为 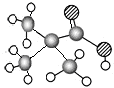 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 现象及结论 |
| 取适量晶体于烧瓶中,加入足量3mol?L-1H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有 | 则晶体中含Na2CO3杂质. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2- | NaCl | H2SO4HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com