
| A、含0.1mol?L-1 HCO3-的溶液中 NH4+、Na+、ClO-、C2H5OH |
| B、SO2的饱和溶液中,Ba2+,K+,NO3-、Cl- |
| C、c(OH-)/c(H+)=1×10-13的溶液中,K+、Ag+、NO3-、I- |
| D、加入酚酞试液是无色的溶液中,Mg2+、Fe3+、Br-、CH3COOH |


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1:1 |
| B、2:1:1 |
| C、3:4:7 |
| D、1:5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①水 ②浓缩菠萝汁 ③蔗糖 ④黄原胶 ⑤维生素C ⑥柠檬黄 ⑦山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 适应条件 |
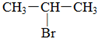 ;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.
;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.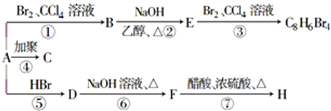
查看答案和解析>>
科目:高中化学 来源: 题型:
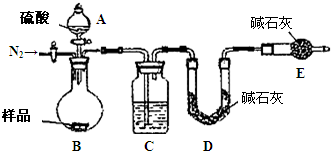 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com