
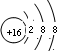
 ,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为
,化合物Na2S属于离子化合物,硫离子和钠离子之间只含离子键,则硫化钠的电子式为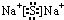 ,Cl和氢形成的化合物为HCl,HCl中H与Cl形成一对共价键,故其电子式为:
,Cl和氢形成的化合物为HCl,HCl中H与Cl形成一对共价键,故其电子式为: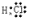 ,故答案为:
,故答案为: ;
;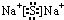 ;
;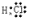 ;
;
| ||


科目:高中化学 来源: 题型:
| A、H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 |
| B、HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 |
| C、HF、CH3CH2OH、KOH都易溶于水,都是电解质 |
| D、HCOOH、H2CO3、H2S分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
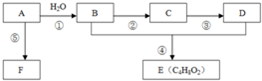 通过石油裂解可以获得A,再以A为原料还可以合成很多的化工产品.已知F可作为保鲜膜的材料,E是有香味的液体.试根据如图回答有关问题:
通过石油裂解可以获得A,再以A为原料还可以合成很多的化工产品.已知F可作为保鲜膜的材料,E是有香味的液体.试根据如图回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含0.1mol?L-1 HCO3-的溶液中 NH4+、Na+、ClO-、C2H5OH |
| B、SO2的饱和溶液中,Ba2+,K+,NO3-、Cl- |
| C、c(OH-)/c(H+)=1×10-13的溶液中,K+、Ag+、NO3-、I- |
| D、加入酚酞试液是无色的溶液中,Mg2+、Fe3+、Br-、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验目的 | 实验室制取氨气 | 用图示的方法能检查此装置的气密性 | 证明硫的非金属性比硅强 | 证明非金属性Cl>C>Si |
| 装置及药品 | 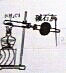 |  | 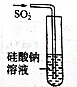 | 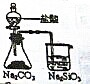 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com