
| 1000ρw |
| M |
| 1000×1.84×98% |
| 98 |
| 0.2mol/L×0.25L |
| 18.4mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 适应条件 |
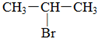 ;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.
;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.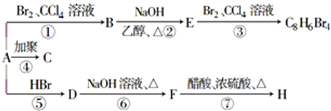
查看答案和解析>>
科目:高中化学 来源: 题型:
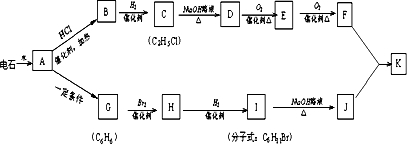
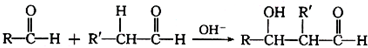
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B | C |
| 装置 | 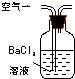 | 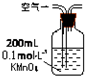 | 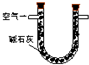 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
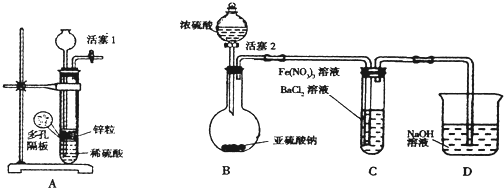
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 分离方法 | 原理 |
| A | CO2中混有的少量CO | 通入适量O2点燃 | CO会燃烧成CO2 |
| B | 除去鸡蛋清胶体中混有的NaCl | 过滤 | 鸡蛋清胶体不能通过滤纸 |
| C | 除去NaHCO3固体中混有的Na2CO3 | 加热 | NaHCO3受热分解 |
| D | 除去BaSO4粉末中混有的BaCO3 | 盐酸溶解后过滤、洗涤 | 盐酸可溶解BaCO3,不溶解BaSO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com