
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为 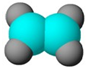 ③组成该有机物的两元素质量比为6:1 | ①由C、H两种元素组成 ②球棍模型为 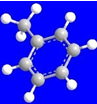 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与D反应生成相对分子质量为130的酯F | ①由C、H、O三种元素组成 ②球棍模型为 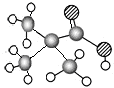 |
 ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,据此解答.
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,据此解答. ;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,
;C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,含有羟基,能与D反应生成相对分子质量为130的酯F,则D属于羧酸,而D由C、H、O三种元素组成,结合D的球棍模型,可知D为(CH3)3C-COOH,结合F的相对分子质量可知,D只能为一元醇,则D的相对分子质量为130+18-102=46,可推知D为CH3CH2OH,F为(CH3)3C-COOCH2CH3,| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
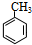
 ,属于烃类物质,不溶于水,含有苯环,能与氢气发生加成反应,含有甲基,能与酸性KMnO4溶液发生氧化反应,并使之褪色,不能与溴水发生取代反应而使溴水褪色,故答案为:①③;
,属于烃类物质,不溶于水,含有苯环,能与氢气发生加成反应,含有甲基,能与酸性KMnO4溶液发生氧化反应,并使之褪色,不能与溴水发生取代反应而使溴水褪色,故答案为:①③; 与浓硝酸反应的化学方程式为:
与浓硝酸反应的化学方程式为: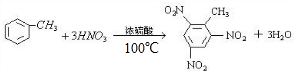 ,
, ;
;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
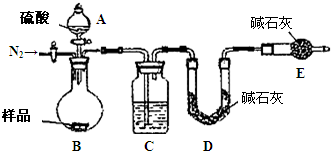 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
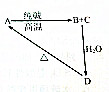 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B | C |
| 装置 | 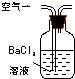 | 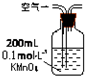 | 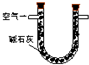 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
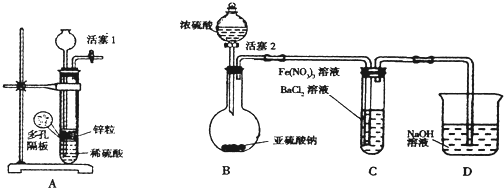
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:R>Q |
| B、R和Q可形成离子化合物 |
| C、R和Q可形成非极性分子RQ2 |
| D、R和Q可形成共价化合物RQ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com