
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
| 1 |
| 3 |
| 1 |
| 15 |
| 1 |
| 3 |
| 1 |
| 15 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
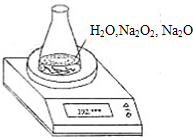 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的硝酸和作氧化剂的硝酸质量比为2:1 |
| B、硝酸都用作氧化剂 |
| C、每个硝酸分子得到2个电子 |
| D、硝酸铜是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | ||||
 |  |  |  | ||||
| 闪电时会发生反应: N2+O2
| 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3 |
| B、取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3 |
| C、取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3 |
| D、取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com