
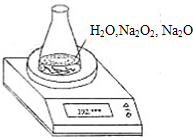
 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |

| 2×78×0.270 |
| 32 |
| 0.4725g |
| 1.560g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②③ |
| C、④⑤ | D、⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、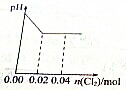 |
B、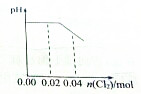 |
C、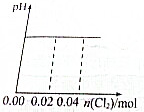 |
D、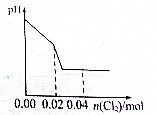 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
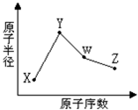 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.查看答案和解析>>
科目:高中化学 来源: 题型:
| D | ||
| A | B | C |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com