
A、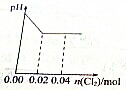 |
B、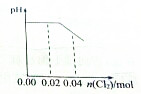 |
C、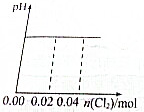 |
D、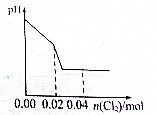 |


科目:高中化学 来源: 题型:
| A、向Fe(NO3)3溶液中加入过量的HI溶液:2NO3+8H++6I═3I2+2NO↑+4H2O |
| B、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、FeCl3溶液中通入过量的H2S气体:2Fe3++H2S═S↓+2Fe2++2H+ |
| D、NaHCO3溶液与过量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
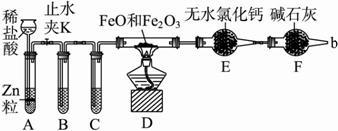
查看答案和解析>>
科目:高中化学 来源: 题型:
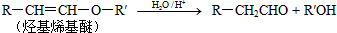

 .
.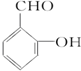 的属于芳香族化合物的两种官能团异构体的结构简式:
的属于芳香族化合物的两种官能团异构体的结构简式: )的一条路线如下
)的一条路线如下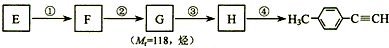
查看答案和解析>>
科目:高中化学 来源: 题型:
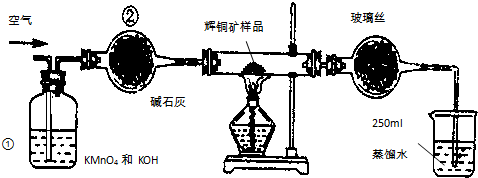
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
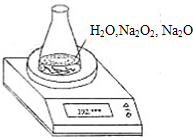 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com