
| A、KOH |
| B、NH3?H2O |
| C、HCl |
| D、H2SO4 |


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
| A、提高尾气净化效率的最佳途径是研制高效催化剂 |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D、570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
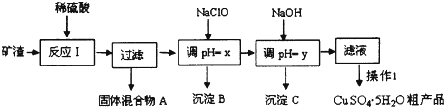
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.7 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.7 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
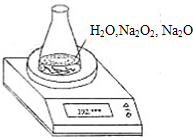 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①水 ②浓缩菠萝汁 ③蔗糖 ④黄原胶 ⑤维生素C ⑥柠檬黄 ⑦山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com