
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
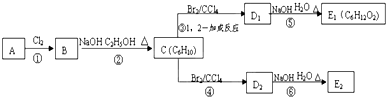
查看答案和解析>>
科目:高中化学 来源: 题型:
| D | ||
| A | B | C |
| E |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
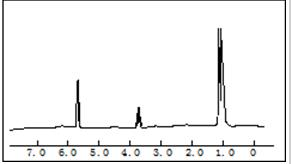 某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |  | |
| 甲 | AlCl3 | NaOH | NaAlO2 | AlCl3 | |
| 乙 | NaOH | AlCl3 | HCl | NH3?H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com