
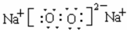 ,
,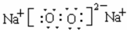 ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| 品 名 | 浓缩菠萝汁 |
| 配 料 | ①水 ②浓缩菠萝汁 ③蔗糖 ④黄原胶 ⑤维生素C ⑥柠檬黄 ⑦山梨酸钾等 |
| 果汁含量 | ≥80% |
| 生产日期 | 标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、他们都用HCl表示两者没有区别 |
| B、氯化氢和盐酸在潮湿的空气中都形成酸雾 |
| C、稀氯化氢和盐酸都能导电 |
| D、氯化氢是无色气体盐酸是无色溶液它们都有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com