
【题目】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)Fe2+是构成人体血红蛋白(如图1所示)的重要元素,基态Fe2+简化的电子排布式为___________;用物质结构与性质知识分析Fe2+在空气中容易被氧化成Fe3+的主要原因:_________________________________________。
(2)血红蛋白中所含非金属元素的电负性由小到大的顺序为___________;碳原子的杂化轨道类型为__________________杂化。
(3)羰基铁[Fe(CO)5]可用作催化剂等。1mol[Fe(CO)5]分子中含有____mol的σ键,与CO互为等电子体的离子的化学式为___________________________(写一种)。
(4)据报道,工业上可电解熔融的FeO、Fe2O3冶炼高纯铁。Fe2O3的熔点____________(填“高于”或“低于”) FeO的熔点,理由是____________________________________________。
(5)铁晶体有面心立方、体心立方。在这两种晶体中铁的配位数之比为______________。
(6)某种氮化铁晶体的晶胞如图2所示。已知:该晶胞边长、高分别为anm、bnm,NA=6.02×1023mol-l
①该氮化铁晶体的化学式为______________。
②列式表示该氮化铁晶体的密度_________________________________________。

【答案】 [Ar]3d6 Fe3+的3d轨道半充满,较稳定,Fe2+容易被氧化为Fe3+ H、C、N、O sp3 、sp2 10 CN- 高于 Fe3+所带电荷数大于Fe2+,Fe3+的半径小于Fe2+,所以Fe2O3 的晶格能大于FeO,熔点高于FeO。 3:2 Fe3N 364/(3![]() NA a2b)g/nm3
NA a2b)g/nm3
【解析】本题主要考查物质结构。
(1)基态Fe2+简化的电子排布式为[Ar]3d6;用物质结构与性质知识分析Fe2+在空气中容易被氧化成Fe3+的主要原因:Fe3+的3d轨道半充满,较稳定,Fe2+容易被氧化为Fe3+。
(2)血红蛋白中所含非金属元素为H、C、N、O,同周期元素非金属性C<N<O,H的非金属性较弱,总之,非金属性H<C<N<O,所以电负性由小到大的顺序为H、C、N、O;单键碳原子的杂化轨道类型为sp3杂化,双键碳原子的杂化轨道类型为sp2杂化。
(3)[Fe(CO)5]分子中CO分子含有一个σ键,每个CO分子与Fe原子之间有一个σ键,共10个σ键,所以1mol[Fe(CO)5]分子中含有10mol的σ键,与CO互为等电子体的离子的化学式为CN-。
(4)Fe2O3的熔点高于FeO的熔点,理由是Fe3+所带电荷数大于Fe2+,Fe3+的半径小于Fe2+,所以Fe2O3的晶格能大于FeO,熔点高于FeO。
(5)铁的面心立方晶体中配位数是12,体心立方晶体中配位数是8。在这两种晶体中铁的配位数之比为3:2。
(6)①晶胞平均含有6个铁原子、2个氮原子,所以该氮化铁晶体的化学式为Fe3N。
②晶胞底面积为底面积为3![]() a2,晶胞体积为3
a2,晶胞体积为3![]() a2b,该氮化铁晶体的密度为364/(3
a2b,该氮化铁晶体的密度为364/(3![]() NA a2b)g/nm3。
NA a2b)g/nm3。


科目:高中化学 来源: 题型:
【题目】微量元素在生物体内虽很少,却是维持正常生命活动不可缺少的,这可以通过下面哪一实例得到说明
A. Mg是叶绿素的组成成分 B. 油菜缺少硼时会出现“花而不实”
C. 动物血液钙盐含量太低会抽搐 D. 缺P会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42﹣浓度为( )
A.0.01 mol/L
B.0.02 mol/L
C.0.03mol/L
D.0.06mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.SO2可用作食品漂白剂B.乙烯可以用作生产食品包装材料的原料
C.酒越陈越香与酯化反应有关D.75%的酒精为消毒酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是
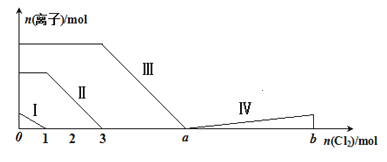
A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序(填各接口处的字母):____接____;____接____;____接____;____接____。
(2)装置中,饱和食盐水的作用是__________________________;
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应方程式__________________。
(4)写出下列化学反应的方程式:
①气体发生装置进行的反应:______________。②NaOH溶液中发生的反应:_____________。
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“单线桥”标出电子转移的方向和数目_________;
②该反应中被氧化和未被氧化的HCl的物质的量之比是________,如果将20 mL、12 mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将________。
A.≥1.68 L B.>1.68 L C.≤1.68 L D.<1.68 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
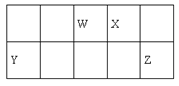
A. 氢化物热稳定性:W<X
B. 最高价氧化物对应水化物的酸性:W<Y
C. Z、W的氢化物的水溶液都呈酸性
D. 简单离子的半径:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物a的分子式和己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是( )
A.a分子中可能有三个甲基
B.a的分子式为C6H10
C.a的一氯代物可能有三种
D.a能与溴的四氯化碳溶液发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】变量控制是科学研究的重要方法。相同质量的碳酸钙与足量1 mol·L-1盐酸分别在下列条件下发生反应,化学反应速率最大的是
选项 | 碳酸钙的状态 | 实验温度/℃ |
A | 粉末 | 10 |
B | 粉末 | 30 |
C | 块状 | 10 |
D | 块状 | 30 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com