
【题目】将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42﹣浓度为( )
A.0.01 mol/L
B.0.02 mol/L
C.0.03mol/L
D.0.06mol/L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
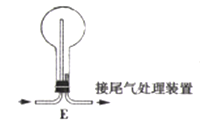
【题目】氨气能与金属氧化物(MxOy) 反应生成M、N2和H2O,根据测定出H2O的量可推出金属M的相对原子质量,某研究小组同学用下列装置进行相关实验探究。请回答下列问题:

(1)按气流方向,正确的装置接口顺序为c![]() _________ (填序号,装置可重复使用)。
_________ (填序号,装置可重复使用)。
(2)装置D中盛放的药品名称为______,装置C的作用是_______.
(3)若实验中准确称取金属氧化物的质量为zg,完全反应后,测得D中生成水的质量为wg.则M的相对原子质量为_____(用含x、y z、w的式子表示)。
(4) 某同学仔细分析上述装置后认为仍存在缺陷。你认为该如何改进:_________.
(5) 某同学用装置A、B、D以及装置E进行NH;的催化氧化实验研究,其中装置D盛放的药品为Na2O2。
①装置B中盛放的药品为________.
②装置A中发生反应的化学方程式为_____________
③验证有NO生成的反应现象为_________,E中发生反应的化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R 是五种短周期元素,原子序数依次增大。X、Y 两元素最高正价与最低负价之和均为 0;Q 与 X 同主族;Z、R 分别是地壳中含量最高的非金属元素和金属元素。 请回答下列问题:
(1)Y 在元素周期表中的位置为_____。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_____
(3)QX 的电子式为_____;QX 与水反应放出气体的化学方程式为_____
(4)X、Z 两元素所形成化合物的电子式为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年7月23日,北京八达岭野生动物园东北虎园内,发生一起老虎伤人事件,可谓震惊异常。东北虎是陆地上最强大的食肉动物之一,当其捕食动物后,从动物体中获得化合物和元素,那么,东北虎和其所捕食动物体内的各种化学元素 ( )
A.种类差异很大,含量大体相同 B.种类和含量差异都很大
C.种类和含量都是大体相同的 D.种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机化学的认识中,错误的是
A. 反应 ![]() 属于取代反应
属于取代反应
B. 淀粉和纤维素属于多糖,在人体内水解转化为葡萄糖,为人类提供能量
C. 分枝酸结构简式如图 ,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
,可与乙醇、乙酸反应,也可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
D. 取蔗糖水解液少许,先滴加过量的NaOH溶液,再滴入新制的氢氧化铜悬浊液,加热,有红色沉淀生成,证明其水解产物具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)Fe2+是构成人体血红蛋白(如图1所示)的重要元素,基态Fe2+简化的电子排布式为___________;用物质结构与性质知识分析Fe2+在空气中容易被氧化成Fe3+的主要原因:_________________________________________。
(2)血红蛋白中所含非金属元素的电负性由小到大的顺序为___________;碳原子的杂化轨道类型为__________________杂化。
(3)羰基铁[Fe(CO)5]可用作催化剂等。1mol[Fe(CO)5]分子中含有____mol的σ键,与CO互为等电子体的离子的化学式为___________________________(写一种)。
(4)据报道,工业上可电解熔融的FeO、Fe2O3冶炼高纯铁。Fe2O3的熔点____________(填“高于”或“低于”) FeO的熔点,理由是____________________________________________。
(5)铁晶体有面心立方、体心立方。在这两种晶体中铁的配位数之比为______________。
(6)某种氮化铁晶体的晶胞如图2所示。已知:该晶胞边长、高分别为anm、bnm,NA=6.02×1023mol-l
①该氮化铁晶体的化学式为______________。
②列式表示该氮化铁晶体的密度_________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

A. Ⅱ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=20.00 mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10.00 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com