
【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
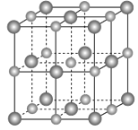
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
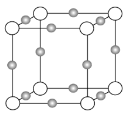
【答案】分子晶体 原子晶体 金属晶体 离子晶体 TiN>MgO>CaO>KCl 铜 3d10 6 正八面体
【解析】
(1)根据各类晶体性质变化规律分析判断晶体类型;
(2)离子晶体的晶格能越大其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,据此判断四种物质熔点高低;
(3) K、L、M三个电子层全充满的X+中原子序数=核内质子数=电子数+电荷数,据此确定该元素,根据原子核外电子排布规律书写该离子的价电子排布式;采用X、Y、Z三轴切割的方法确定X+个数,根据Cu+在N3-周围的相对位置确定其构成的空间构型。
(1) A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2,说明晶体A属于分子晶体;
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃,则晶体B为原子晶体;
C.固态和熔融态时都能导电,能溶于盐酸,则晶体C为金属晶体;
D.固态时不导电,液态时能导电,可溶于水,证明晶体D为离子晶体;
(2)离子晶体的晶格能越大,其熔点越高,晶格能与离子电荷成正比,与离子半径成反比,N3-电荷大于Mg2+和Ca2+,Mg2+和Ca2+电荷大于K+,Mg2+和半径小于Ca2+半径,所以4种离子晶体熔点从高到低的顺序是TiN>MgO>CaO>KCl;
(3)某离子X+中所有电子正好充满K、L、M三个电子层,该离子含有28个电子,则该原子含有29个电子,元素X为铜元素,Cu原子核外电子排布是1s22s22p63s23p63d104s1,故X+的价电子排布式为3d10;采用X、Y、Z三轴切割的方法知X+个数是6;这六个Cu+构成的是正八面体结构。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是

A.用水湿润的pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol· L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:![]()
![]() 在含
在含![]() 价铬的废水中加入一定量的硫酸和硫酸亚铁,使
价铬的废水中加入一定量的硫酸和硫酸亚铁,使![]() 价铬还原成
价铬还原成![]() 价铬;再调节溶液pH在
价铬;再调节溶液pH在![]() 之间,使
之间,使![]() 和
和![]() 转化为
转化为![]() 、
、![]() 沉淀而除去.
沉淀而除去.
![]() 写出
写出![]() 与
与![]() 溶液在酸性条件下反应的离子方程式 ______ .
溶液在酸性条件下反应的离子方程式 ______ .
![]() 用离子方程式表示溶液pH不能超过10的原因 ______ .
用离子方程式表示溶液pH不能超过10的原因 ______ .
![]() 将含
将含![]() 价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的
价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的![]() 和
和![]() 发生反应,生成的
发生反应,生成的![]() 和
和![]() 在阴极区与
在阴极区与![]() 结合成氢氧化物沉淀而除去.
结合成氢氧化物沉淀而除去.
![]() 写出阴极的电极反应式 ______ .
写出阴极的电极反应式 ______ .
![]() 电解法中加入氯化钠的作用是 ______ .
电解法中加入氯化钠的作用是 ______ .
![]() 某化学兴趣小组以含
某化学兴趣小组以含![]() 价铬和
价铬和![]() 价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
![]() 取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
![]() 取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水
取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水![]() ______ 时,锰、铬去除率最好.
______ 时,锰、铬去除率最好.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】皮革工业污泥中含较多的Cr,工业采用以下工芝制得M[Cr(OH)(H20)5S04]。
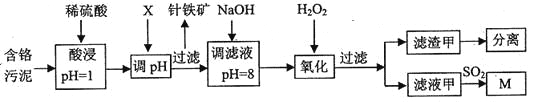
已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 6.7 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 9.3 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________(任写一条)。
(2)调节pH所用X可以选用______。
A.NaOH B.Na2C03C.H2S04D.HN03
(3)加入H202目的,是把Cr(OH)3沉淀转化为Cr2072-。该转化过程中,消耗的H202与Cr(OH)3的物质的量之比为________。
(4)调滤液至pH=8,则滤液中______将转化为沉淀(选填Al3+、Cu2+、Mg2+)。
(5)若滤液甲的pH=a,则溶液中c(Cu2+)=______。(25°C时的Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
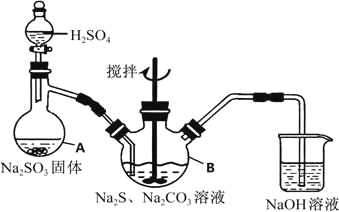
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O35H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称_____________,步骤④中洗涤时,为了减少产物的损失的试剂可以是_______
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因_____________
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论_____________
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000molL﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为_______mL,产品的纯度为_______%
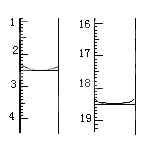
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如图:
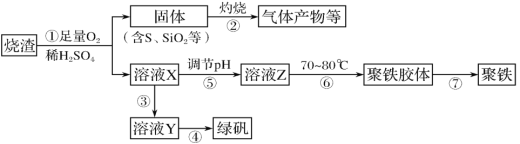
(1)将过程②中产生的气体通入下列溶液中,溶液不褪色的是__(填选项序号)。
A.酸性KMnO4溶液 B.品红溶液 C.紫色石蕊溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为__。
(3)过程③中,需加入的物质是__,反应的离子方程式为__。
(4)用溶液Y制绿矾时,检验溶液Y中是否含有Fe3+的操作是__。
(5)在实验室里,完成过程④中的操作名称是__。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:
①用分析天平称取2.240g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥、称量,得固体质量为2.330g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为__。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,2NA个CO2分子占有的体积为44.8L
B.常温常压下,8.4gNaHCO3含有的Na+数目为0.1NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到检流计的指针发生了偏转。

请回答下列问题:
(1)甲池为________(填“原电池”、“电解池”或“电镀池”),通入CH3OH一极的电极反应式为_____________________________________________________________;
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”、“阴极”或“阳极”),总反应式为_________________________________________________________;
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________ mL(标准状况),丙池中________极析出________ g铜;
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”);丙中溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 常温下,用pH 计分测 | pH | 酸性: |
B | 向 | 溶液褪色 | 乙二酸具有还原性 |
C |
| 先有白色沉淀,后沉淀消失 |
|
D | 取2mL | 先有白色沉淀生成;后有红褐色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com