
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如图:
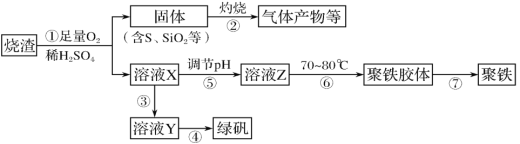
(1)将过程②中产生的气体通入下列溶液中,溶液不褪色的是__(填选项序号)。
A.酸性KMnO4溶液 B.品红溶液 C.紫色石蕊溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为__。
(3)过程③中,需加入的物质是__,反应的离子方程式为__。
(4)用溶液Y制绿矾时,检验溶液Y中是否含有Fe3+的操作是__。
(5)在实验室里,完成过程④中的操作名称是__。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:
①用分析天平称取2.240g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥、称量,得固体质量为2.330g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为__。(假设杂质中不含铁元素和硫元素)
【答案】C 4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S Fe(或铁) 2Fe3++Fe=3Fe2+ 取少量的溶液Y于试管中,滴加硫氰化钾溶液,若溶液变红,则含有Fe3+,若溶液不变红,则不含有Fe3+ 蒸发浓缩、冷却结晶 25.0%
【解析】
煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)中通入足量O2,并加入稀硫酸,铁的氧化物溶于稀硫酸生成硫酸铁和水,FeS、O2、H2SO4反应生成Fe2(SO4)3、S和水;所得固体(含S、SiO2)灼烧,S与O2反应生成SO2;溶液X为Fe2(SO4)3溶液,加入Fe,可将Fe3+还原为Fe2+,从而获得绿矾;调节溶液X的pH,Fe3+发生水解生成聚铁胶体。
(1)将过程②中产生的气体为SO2,具有较强的还原性和漂白性,能将酸性KMnO4溶液、溴水还原,能使品红褪色,但只能使紫色石蕊溶液变红色,故选C。答案为:C;
(2)过程①中,FeS和O2、H2SO4发生氧化还原反应,生成Fe2(SO4)3、S和水,化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S。答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)过程③中,需加入还原剂,将Fe3+还原为Fe2+,同时不引入新的杂质,所以该物质是Fe(或铁),反应的离子方程式为2Fe3++Fe=3Fe2+。答案为:Fe(或铁);2Fe3++Fe=3Fe2+;
(4)用溶液Y[Fe2(SO4)3]制绿矾时,检验溶液Y中是否含有Fe3+,常使用KSCN溶液,其操作是取少量的溶液Y于试管中,滴加硫氰化钾溶液,若溶液变红,则含有Fe3+,若溶液不变红,则不含有Fe3+。答案为:取少量的溶液Y于试管中,滴加硫氰化钾溶液,若溶液变红,则含有Fe3+,若溶液不变红,则不含有Fe3+;
(5)过程④为从FeSO4溶液中获得绿矾,应采用蒸发浓缩、冷却结晶的方法,所以完成过程④中的操作名称是蒸发浓缩、冷却结晶。答案为:蒸发浓缩、冷却结晶;
(6)m(BaSO4)=2.330g,聚铁的主要成分为[Fe(OH)SO4]n,n(Fe3+)= n(![]() )=
)=![]() =0.01mol,则聚铁样品中铁元素的质量分数为
=0.01mol,则聚铁样品中铁元素的质量分数为![]() =25.0%。答案为:25.0%。
=25.0%。答案为:25.0%。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的流程如图所示(框图中是主要产物):
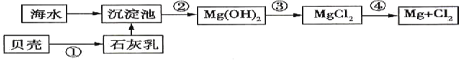
请回答相关问题。
(1)下列说法不正确的是____________。
A.上述方法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集![]()
C.工业上也可用电解熔融氧化镁的方法制取镁 D.电解法冶炼金属要消耗大量的电能
(2)步骤③中发生反应的离子方程是__________________________。
(3)步骤④中发生反应的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
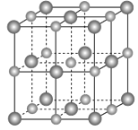
【题目】某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为( )

A. 1∶4∶2 B. 3∶9∶4
C. 2∶9∶4 D. 3∶8∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
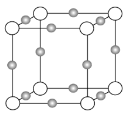
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。

请根据图示回答下列问题:
(1)图中a电极是______(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为_________________________________________。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为____________________________。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是__。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaOH | 制氯气并吸收尾气 | |
B | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸>硅酸 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产和日常生活必须注意消防安全,下列行为不利于消防安全的是( )
A.天然气管道在输送天然气前先通入氦气
B.天然气中含“加臭剂“气体,用于警示气体泄露
C.用蘸浓氨水的棉棒检验输送氯气的管道是否泄露
D.用燃着的木条检验家用液化气钢瓶是否泄露
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com