
【题目】下表是![]() 时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl |
|
| HClO |
|
Ksp或Ka |
|
|
|
|
|
A.相同浓度![]() 和NaClO的混合液中,各离子浓度的大小关系是
和NaClO的混合液中,各离子浓度的大小关系是![]()
B.向![]() 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至![]() :
:![]() :9,此时溶液
:9,此时溶液![]()
C.碳酸钠溶液中滴加少量氯水的离子方程式为![]()
D.向浓度为![]() 的KCl和
的KCl和![]() 混合液中滴加
混合液中滴加![]() 的
的![]() 溶液,
溶液,![]() 先形成沉淀。
先形成沉淀。
科目:高中化学 来源: 题型:
【题目】化工生产中常利用硫酸厂煅烧黄铁矿石的烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),流程如图:
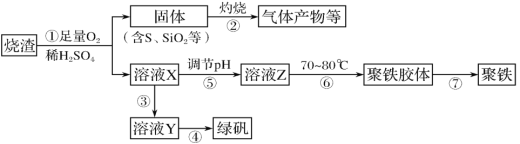
(1)将过程②中产生的气体通入下列溶液中,溶液不褪色的是__(填选项序号)。
A.酸性KMnO4溶液 B.品红溶液 C.紫色石蕊溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为__。
(3)过程③中,需加入的物质是__,反应的离子方程式为__。
(4)用溶液Y制绿矾时,检验溶液Y中是否含有Fe3+的操作是__。
(5)在实验室里,完成过程④中的操作名称是__。
(6)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验:
①用分析天平称取2.240g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥、称量,得固体质量为2.330g。若该聚铁的主要成分为[Fe(OH)SO4]n,则聚铁样品中铁元素的质量分数为__。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员采用新型锰催化体系,选择性实现了简单酮与亚胺的芳环惰性C-H的活化反应。利用该反应制备化合物J的合成路线如图:

已知:RNH2+ +H2O
+H2O
回答下列问题:
(1)A中官能团的名称是___,F的化学名称是__。
(2)G的结构简式为___。
(3)由C生成E,E和H生成J的反应类型分别是__、___。
(4)C和D生成E的化学方程式为___。
(5)芳香化合物K是E的同分异构体。若K能发生银镜反应,则K可能的结构有___种,其中核磁共振氢谱有四组峰的结构简式为__(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是利用一种微生物将废水中尿素![]() 的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。回答下列问题:
的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。回答下列问题:
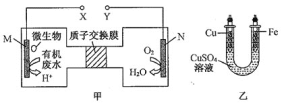
![]() 铜电极应该与 ______电极相连,Fe电极的电极反应式__________
铜电极应该与 ______电极相连,Fe电极的电极反应式__________
![]() 甲中
甲中![]() 通过质子交换膜向_____极移动,M电极的电极方程式_______
通过质子交换膜向_____极移动,M电极的电极方程式_______
![]() 当铜电极减重___g,Fe电极增重16g,N极消耗气体的体积
当铜电极减重___g,Fe电极增重16g,N极消耗气体的体积![]() 标准状况下
标准状况下![]() 为____L。
为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 常温下,用pH 计分测 | pH | 酸性: |
B | 向 | 溶液褪色 | 乙二酸具有还原性 |
C |
| 先有白色沉淀,后沉淀消失 |
|
D | 取2mL | 先有白色沉淀生成;后有红褐色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某温度(t℃)时,水的电离图象如下图所示,a点水的离子积Kw=_____该温度下,pH=11的NaOH溶液与pH=2的H2SO4溶液等体积混合,溶液显_____(填“酸”或“碱”)性。
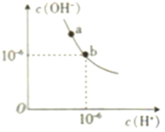
(2)25℃时,向0.1molL-1的氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH_____(填“增大”“减小”或“不变”,下同),![]() 的物质的量浓度_____
的物质的量浓度_____
(3)将体积相等的NaOH稀溶液和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显_____(填“酸性”“碱性”或“中性”),则混合前c(NaOH)_____(填“>”“<”或“=”)c(CH3COOH)
(4)常温下,Ksp[Fe(OH)3]=1×10-38,要使溶液中的Fe3+沉淀完全[残留在溶液中的c(Fe3+)<10-5molL-1],则溶液的pH应大于_____
(5)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程中会发生反应:CaSO4(s)+![]() (ag)CaCO3(s)+
(ag)CaCO3(s)+![]() (aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____(计算结果保留三位有效数字)。
(aq)。已知:298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_____(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A. 氢氧燃料电池工作时,![]() 在负极上失去电子
在负极上失去电子
B. ![]() 溶液加热后,溶液的pH减小
溶液加热后,溶液的pH减小
C. 常温常压下,![]() 中含有的分子数为
中含有的分子数为![]() 个
个
D. 室温下,稀释![]() 溶液,溶液的导电能力增强
溶液,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂鉴别![]() 、CH3CH2OH、CH3CH2Br三种无色液体,下列试剂不能实现的是
、CH3CH2OH、CH3CH2Br三种无色液体,下列试剂不能实现的是
A.Br2的CCl4溶液B.溴水C.酸性高锰酸钾溶液D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,0.1molN2(g)与0.3molH2(g)在密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
2NH3(g) △H=-akJ·mol-1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,反应放出0.la kJ热量
B. 达到化学平衡状态时,v正(NH3):v逆(N2)=2:1
C. n( N2):n(H2):n(NH3)=l:3:2时,说明该反应达到平衡
D. 缩小容器体积,用氮气表示的反应速率:v正(N2)增大,v逆(N2)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com