
【题目】含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知:![]()
![]() 在含
在含![]() 价铬的废水中加入一定量的硫酸和硫酸亚铁,使
价铬的废水中加入一定量的硫酸和硫酸亚铁,使![]() 价铬还原成
价铬还原成![]() 价铬;再调节溶液pH在
价铬;再调节溶液pH在![]() 之间,使
之间,使![]() 和
和![]() 转化为
转化为![]() 、
、![]() 沉淀而除去.
沉淀而除去.
![]() 写出
写出![]() 与
与![]() 溶液在酸性条件下反应的离子方程式 ______ .
溶液在酸性条件下反应的离子方程式 ______ .
![]() 用离子方程式表示溶液pH不能超过10的原因 ______ .
用离子方程式表示溶液pH不能超过10的原因 ______ .
![]() 将含
将含![]() 价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的
价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的![]() 和
和![]() 发生反应,生成的
发生反应,生成的![]() 和
和![]() 在阴极区与
在阴极区与![]() 结合成氢氧化物沉淀而除去.
结合成氢氧化物沉淀而除去.
![]() 写出阴极的电极反应式 ______ .
写出阴极的电极反应式 ______ .
![]() 电解法中加入氯化钠的作用是 ______ .
电解法中加入氯化钠的作用是 ______ .
![]() 某化学兴趣小组以含
某化学兴趣小组以含![]() 价铬和
价铬和![]() 价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响.
![]() 取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
取100mL废水于250mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如图1所示.则在pH一定时,废水中铁屑用量为 ______ 时,锰、铬去除率最好.
![]() 取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水
取100mL废水于250mL三角瓶中,加入规定量的铁粉,调成不同的pH值.得到pH值对铬和锰去除率的影响如图2所示.则在铁屑用量一定时,废水![]() ______ 时,锰、铬去除率最好.
______ 时,锰、铬去除率最好.

【答案】![]()
![]()
![]() 或
或![]() 增强溶液导电性
增强溶液导电性 ![]() 4
4
【解析】
(1)①二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,根据电子得失配平;
②由题意可知,当pH超过10即c(OH-)≥10-4mol![]() L-1时,Cr(OH)3转变成CrO2-,
L-1时,Cr(OH)3转变成CrO2-,
(2)①阴极上水中的氢离子放电生成氢气;
②水是弱电解质,导电性能较差,氯化钠是强电解质能增强水的导电性;
(3)根据图可知,当两种离子的去除率都较大时所对应的pH值和百分量即可。
![]() 二价铁离子有还原性,
二价铁离子有还原性,![]() 有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,
有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,![]() 被还原为
被还原为![]() ,反应方程式为:
,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 由题意可知,当pH超过10即
由题意可知,当pH超过10即![]() 时,
时,![]() 转变成
转变成![]() ,发生
,发生![]() ,故答案为:
,故答案为:![]() ;
;
![]() 将含
将含![]() 价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为:
价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阳极上铁失电子生成二价铁离子,阴极上氢离子得电子生成氢气,电极反应式为:![]() 或
或![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
![]() 水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,故答案为:增强溶液导电性;
水是弱电解质,所以蒸馏水的导电能力很小,氯化钠是强电解质,在水中能完全电离导致溶液阴阳离子浓度增大,所以能增强溶液导电性,故答案为:增强溶液导电性;
![]() 根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为
根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为![]() 时,锰、铬去除率最好;故答案为:
时,锰、铬去除率最好;故答案为:![]() ;
;
![]() 根据图2知,当溶液的pH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当
根据图2知,当溶液的pH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当![]() 时,锰、铬去除率最好;故答案为:4。
时,锰、铬去除率最好;故答案为:4。


科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某学习小组模拟化工生产设计了如下流程制备精铜。

已知:Cu2O + 2 H+ = Cu + Cu2+ + H2 O
回答下列问题:
(1)实际生产中,常将铜矿石粉碎的目的是______________________________。
(2)滤渣1中含有较多的铜,提纯滤渣1时反应的离子方程式为_______________________________。
(3)滤液1中铁元素的存在形式为______________(填离子符号),检验该离子的常用试剂为________________。
(4)写出加入铝粉时生成铜的化学方程式:______________________________。
(5)“电解”精炼过程中,粗铜与外接电源的___________极相连;阴极的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题。
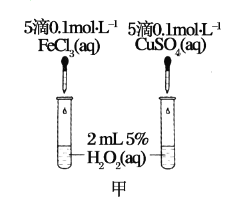
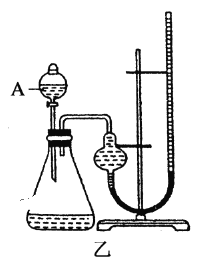
(1)定性如图甲可通过观察_______________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________。
(2)定量如图乙所示,实验时均以生成20mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是________,为了减少实验误差,反应前后量气管两边液面的高度应保持一致,则在反应后应采取的操作方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氯酸钾能氧化Ag、Zn等金属。从一种银矿![]() 含Ag、Zn、Cu、Pb及少量
含Ag、Zn、Cu、Pb及少量![]() 中提取Ag、Cu及Pb的工艺流程如下:
中提取Ag、Cu及Pb的工艺流程如下:
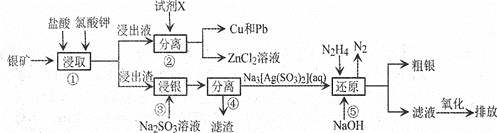
![]() 步骤
步骤![]() 提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________
提高矿物中金属离子浸取率除可改变盐酸的浓度和氯酸钾的量,还可采取的措施是________![]() 写出两种即可
写出两种即可![]() 。
。
![]() 步骤
步骤![]() 试剂X为________
试剂X为________![]() 填化学式,下同
填化学式,下同![]() ;步骤
;步骤![]() 滤渣的成分为________。
滤渣的成分为________。
![]() 步骤
步骤![]() 发生反应的化学方程式为________。
发生反应的化学方程式为________。
![]() 步骤
步骤![]() 发生反应的离子方程式为________;其中
发生反应的离子方程式为________;其中![]() 肼
肼![]() 的电子式为________。
的电子式为________。
![]() 还原后的“滤液”经氧化后,其中的溶质为________。
还原后的“滤液”经氧化后,其中的溶质为________。
![]() 粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
粗银常用电解精炼法提纯,用粗银作阳极,银片作阴极,硝酸银和稀硝酸的混合溶液作电解液,在阴极上有无色气体产生,在液面上方变为红棕色。电解时阴极发生的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的流程如图所示(框图中是主要产物):
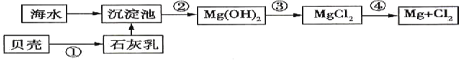
请回答相关问题。
(1)下列说法不正确的是____________。
A.上述方法的优点之一是原料取自大海 B.进行①②③步骤的目的是富集![]()
C.工业上也可用电解熔融氧化镁的方法制取镁 D.电解法冶炼金属要消耗大量的电能
(2)步骤③中发生反应的离子方程是__________________________。
(3)步骤④中发生反应的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可用作食品保鲜剂(不直接加入食品中,安全、卫生),还可用于纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4用于保鲜剂时能去除O2,先生成Na2SO3并缓慢释放SO2,该反应的化学方程式为________。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
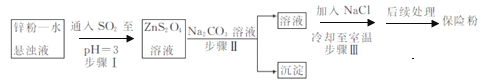
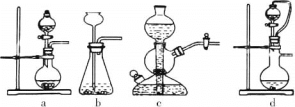
①实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
②工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_______。步骤Ⅱ中发生反应的化学方程式为___。
③在步骤.中得到的Na2S2O4固体要用乙醇洗涤,其优点是_______。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加人乙 醇水溶液液中,然后通入SO2发生反应,有CO2气体放出,总反应的化学方程式是___________。
(4)连二亚硫酸钠的分析检测。铁氰化钾法:铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将S2O42-氧化为SO32-,[Fe(CN)6]3-还原为[Fe(CN)6]4-。取50.00mLNa2S2O4样品溶液,用0.02molL-1的K3[Fe(CN)6]标准液滴定至终点,消耗10.00mL。该样品中Na2S2O4的含量为_______gL-1。(以SO2计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】确定物质性质的重要因素是物质结构。请回答下列问题。
(1)A、B、C、D为四种晶体,性质如下:
A.固态、液态时均不导电,熔点-120 ℃,能溶于CS2
B.固态、液态时大多不导电,硬度很大,熔点为3500 ℃
C.固态和熔融态时都能导电,能溶于盐酸
D.固态时不导电,液态时能导电,可溶于水
试推断它们的晶体类型:
A.______; B.______; C._____; D._____。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示,其中TiN中N呈-3价),已知其中3种离子晶体的晶格能数据如下表:
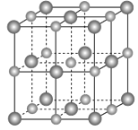
离子晶体 | KCl | MgO | CaO |
晶格能/kJ·mol-1 | 715 | 3791 | 3401 |
则该4种离子晶体的熔点从高到低的顺序是______。
(3)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的结构如下图所示。X的元素名称是_____,X+的价电子排布式为_____,与同一个N3-相连的X+有_____个,这几个X+所形成的空间构型为_____。
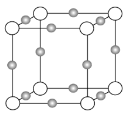
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物稳定性:R<W
C.WX3和水反应生成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com