
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
【答案】B
【解析】
试题A.在一定条件下,使用催化剂能加快反应速率。正确。B.当反应达平衡时,恒温恒压条件下通入Ar,,则容器的容积就要扩大。各种物质的浓度就减小。由于生成物的系数大,所以生成物的浓度减小的多,反应物减小的少,所以化学平衡正向移动,COCl2的转化率增大。错误。C.单位时间内生成CO和Cl2的物质的量比为1∶1,若单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,则消耗Cl2的物质的量与生成的Cl2的物质的量相等,反应达到平衡状态。正确。D.平衡时,其他条件不变,升高温度,化学平衡向吸热反应方向移动,由于个反应为放热反应,所以升高温度,化学平衡逆向移动。故可使该反应的平衡常数减小。正确。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。

(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充型电池,起反应为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O:,下列说法正确的是
2PbSO4+2H2O:,下列说法正确的是
A. 放电时负极质量减少,正极质量增加,电解质溶液中H2SO4的浓度将变小
B. 放电时负极的电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O
C. 充电时Pb与电源正极相连
D. 充电时阳极上pbSO4变为PbO2,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备下列物质的生产流程合理的是( )
A. 由铝土矿冶炼铝:铝土矿![]() Al2O3
Al2O3![]() AlCl3
AlCl3![]() Al
Al
B. 从海水中提取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. 由NaCl制漂白粉:饱和食盐水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D. 由黄铁矿制硫酸:黄铁矿![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马航失联事件震惊中外,事件发生后,联合搜救部门启用了“金枪鱼”水下搜救器展开水下搜救,其中![]() 电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为
电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为![]() ,则下列说法错误的是
,则下列说法错误的是![]()
![]()
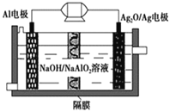
A.Al电极做负极,电极反应式为:![]()
B.工作时电解液中的OH-移向![]() 电极
电极
C.工作时正极发生还原反应,负极不断减重
D.当电极上生成![]() 时,电路中转移的电子为0.01mol
时,电路中转移的电子为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中c(H+)/c(CH3COO-)减小
C. 反应TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g);ΔH>0能自发进行,其原因是ΔS>0
D. 一定温度下,增大反应2BaO2(s)![]() 2BaO(s) +O2(g)容器的体积,平衡不移动
2BaO(s) +O2(g)容器的体积,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
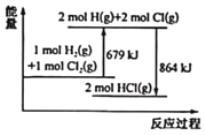
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有一反应:3Fe2++2S2O32—+O2+xOH-===Fe3O4+S4O62—+2H2O,下列说法中不正确的是( )
A.x=4
B.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
C.Fe2+和S2O32—都是还原剂
D.每生成1molFe3O4,反应转移的总电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
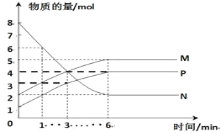
(1)反应化学方程式中各物质的系数比为a:b:c=______。
(2)1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_____。
(3)下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗amolN,同时消耗bmolM
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com