

| 催化剂、350℃ |

 ,根据加聚反应原理判断B的结构简式;
,根据加聚反应原理判断B的结构简式; 与NaOH的水溶液共热反应生成CH3COOH和C
与NaOH的水溶液共热反应生成CH3COOH和C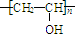 ,该反应为水解反应;
,该反应为水解反应;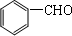 含有醛基,所以能与新制的Cu(OH)2反应生成
含有醛基,所以能与新制的Cu(OH)2反应生成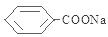 、Cu2O和H2O;
、Cu2O和H2O; 与乙酸发生反应得到D:
与乙酸发生反应得到D: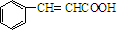 ,
,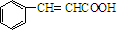 分子中含有羧基,能与Na和NaOH溶液反应放出氢气;
分子中含有羧基,能与Na和NaOH溶液反应放出氢气;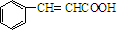 分子中含有不饱和的碳碳双键,能够被酸性高锰酸钾氧化,能够与溴发生加成反应;
分子中含有不饱和的碳碳双键,能够被酸性高锰酸钾氧化,能够与溴发生加成反应;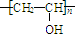 、D
、D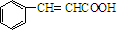 发生反应得到聚酯和水,据此写出反应的化学方程式.
发生反应得到聚酯和水,据此写出反应的化学方程式. ,所以B的结构简式为:CH2=CHOOCCH3,
,所以B的结构简式为:CH2=CHOOCCH3, 与NaOH的水溶液共热发生水解反应(或取代反应)得到CH3COOH和C
与NaOH的水溶液共热发生水解反应(或取代反应)得到CH3COOH和C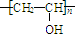 ,
,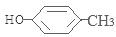 ,
, ;
; 含有醛基,所以能与新制的Cu(OH)2反应,该反应的化学方程式是:
含有醛基,所以能与新制的Cu(OH)2反应,该反应的化学方程式是: +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH | △ |
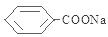 +Cu2O↓+3H2O,
+Cu2O↓+3H2O, +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH | △ |
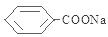 +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 与乙酸发生反应得到D,D的结构简式为:
与乙酸发生反应得到D,D的结构简式为: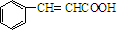 ,
,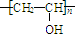 与D
与D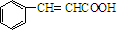 发生反应③得到聚酯和水,反应的化学方程式为:
发生反应③得到聚酯和水,反应的化学方程式为: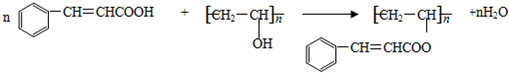 ,
,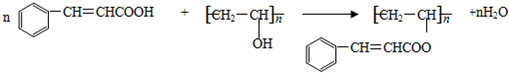 .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种物质不能用焰色反应进行鉴别 |
| B、两种物质作为膨松剂的作用原理相同 |
| C、等质量的两种物质中所含铝的质量相同 |
| D、两种物质与足量NaOH溶液共热反应的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离乙醇和碘的混合物 | CCl4萃取 | 碘在CCl4中溶解度较大 |
| B | 除去CO2中的SO2 | NaOH溶液洗气 | SO2能与NaOH反应 |
| C | 除去氧化钙中的碳酸钙 | 水,过滤 | 碳酸钙不溶于水 |
| D | 分离碘和苯的混合物 | 蒸馏 | 苯蒸气冷凝回收苯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com