
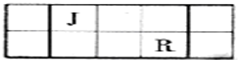
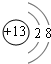
 ;元素T在周期表中位于第ⅦA族,
;元素T在周期表中位于第ⅦA族, ;ⅦA;
;ⅦA;

 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
 在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )
在一密闭容器中进行以下可逆反应:M(g)+N(g)?P(g)+2L.在不同的条件下P的百分含量P%的变化情况如图,则该反应( )| A、正反应放热,L是固体 |
| B、正反应放热,L是气体 |
| C、正反应吸热,L是气体 |
| D、正反应放热,L是固体或气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、③④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计如图实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
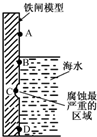 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.查看答案和解析>>
科目:高中化学 来源: 题型:
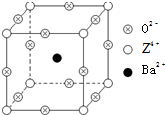 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
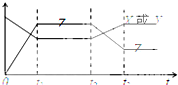 现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )| A、增大了X或Y的浓度 |
| B、增大压强 |
| C、增大Z的浓度 |
| D、升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com