
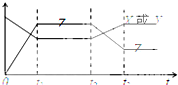
 现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )| A、增大了X或Y的浓度 |
| B、增大压强 |
| C、增大Z的浓度 |
| D、升高温度 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
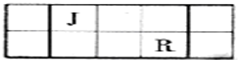
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、欲将蛋白质从水中析出而又不改变它的性质,应加入CuSO4溶液 |
| B、乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
| C、淀粉溶液中加入一定量稀硫酸,共热一段时间后,向溶液中加入新制氢氧化铜悬浊液并加热煮沸,未见红色固体产生,证明淀粉没有发生水解 |
| D、可用NaOH溶液除去混在乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、200ml某硫酸盐中含有1.5NA个SO
| ||
| B、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA | ||
| C、常温常压下78gNa2O2固体中所含阴、阳离子总数为4NA | ||
| D、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液一定呈中性 |
| B、酸和碱的物质的量一定相等 |
| C、酸和碱的物质的量浓度相等 |
| D、酸能提供的H+与碱能提供的OH-的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.15mol/(L?min) |
| B、v (B)=0.6 mol/(L?min) |
| C、v (C)=0.3 mol/(L?min) |
| D、v (D)=0.1 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、加NaOH,HA电离平衡常数增大 |
| B、b点溶液中,c(HA)<c(A-) |
| C、溶液中水的电离程度a>b>c |
| D、通入HCl,溶液中阴离子浓度之和减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com