
A、200ml某硫酸盐中含有1.5NA个SO
| ||
| B、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA | ||
| C、常温常压下78gNa2O2固体中所含阴、阳离子总数为4NA | ||
| D、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
| 1 |
| 3 |
| 0.5mol |
| 0.2L |


科目:高中化学 来源: 题型:
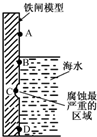 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
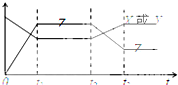 现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H<0.如图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡,则在图中t2s时改变的条件可能是( )| A、增大了X或Y的浓度 |
| B、增大压强 |
| C、增大Z的浓度 |
| D、升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe-3e-=Fe3+ |
| B、O2+2H2O+4e-=4OH- |
| C、Fe-2e-=Fe2+ |
| D、O2+2H2O-4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- |
| B、在溶液中SO42-往b极移动 |
| C、若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D、若a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4 |
| B、过量Cl2 |
| C、FeCl3 |
| D、FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业中,离子交换膜的作用是防止离子运动 |
| B、硫酸、硝酸、合成氨均使用了催化剂 |
| C、石油裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
| D、氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com