
| A、KMnO4 |
| B、过量Cl2 |
| C、FeCl3 |
| D、FeCl2 |


科目:高中化学 来源: 题型:
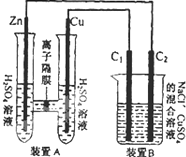 有如图装置,回答下列问题:
有如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、200ml某硫酸盐中含有1.5NA个SO
| ||
| B、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA | ||
| C、常温常压下78gNa2O2固体中所含阴、阳离子总数为4NA | ||
| D、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,46g NO2中含有的分子数为NA |
| B、通常状况下,14g CO含有的电子数目为7NA |
| C、1L 0.2 mol/L的CH3COOH溶液中,H+数目为0.2NA |
| D、0.1mol Cu 和与40mL 10mol/L硝酸反应后,溶液中的NO3-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.15mol/(L?min) |
| B、v (B)=0.6 mol/(L?min) |
| C、v (C)=0.3 mol/(L?min) |
| D、v (D)=0.1 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2Ag2O
| ||||
B、铝的制备:2Al2O3(熔融)
| ||||
C、工业冶炼铁:4CO+Fe3O4
| ||||
D、无水氯化镁的制备:MgCl2?6H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al与S直接化合时可得到Al2S3,则Fe与S直接化合时也可得到Fe2S3 |
| B、CO2通入到硝酸钡溶液中不能生成沉淀,则SO2通入到硝酸钡溶液中也不能生成沉淀 |
| C、乙醛能被银氨溶液氧化,则也能被酸性高锰酸钾溶液氧化 |
| D、Mg(OH)2饱和溶液中c(OH-)=2c(Mg2+),则Al(OH)3饱和溶液中c(OH-)=3c(Al3+) 已知 Ksp[Mg(OH)2]=5.6×10-12,Ksp[Al(OH)3]=2.7×10-32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol?L-1 | 0.6 | 1.2 | 1.2 |
| A、此时反应v正<v逆 |
| B、平衡后升高温度,K>400 |
| C、达平衡后再通入H2O(g),甲醇的体积分数一定减小 |
| D、平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 |
| B、定容时俯视刻度线 |
| C、定容时仰视刻度线 |
| D、干净的容量瓶未经干燥就用于配制溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com