
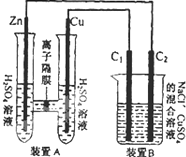
 有如图装置,回答下列问题:
有如图装置,回答下列问题:| 32.5g |
| 65g/mol |


科目:高中化学 来源: 题型:
| 选 项 | 方 法 | 对 相 应 方 法 的 描 述 |
| A | 改变金属内部的组成结构 | 此法实际上是将金属制成合金,增强抗腐蚀能力 |
| B | 在金属表面覆盖保护层 | 保护层破损后,就完全失去了对金属的保护作用 |
| C | 外加电流的阴极保护法 | 接外加直流电源构成电解池,被保护的金属作阴极 |
| D | 牺牲阳极的阴极保护法 | 构成原电池,被保护的金属作正极 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
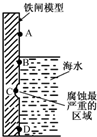 铁及其化合物与生产、生活关系密切.
铁及其化合物与生产、生活关系密切.查看答案和解析>>
科目:高中化学 来源: 题型:
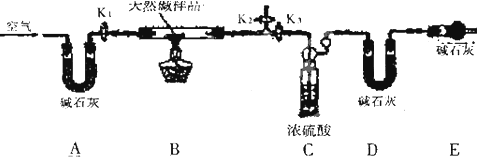
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KMnO4 |
| B、过量Cl2 |
| C、FeCl3 |
| D、FeCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com