
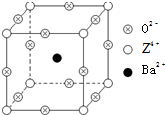
 已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:1型常见气态氢化物分子中既有σ键又有π键.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐).M有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.

科目:高中化学 来源: 题型:
 物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:
物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
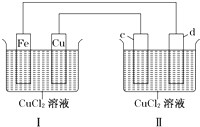 下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:
下列装置可实现电解CuCl2溶液,c、d均为石墨.读图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
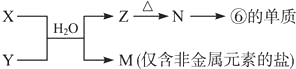
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液一定呈中性 |
| B、酸和碱的物质的量一定相等 |
| C、酸和碱的物质的量浓度相等 |
| D、酸能提供的H+与碱能提供的OH-的物质的量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com