
【题目】体积相同、pH相同的HCl溶液和CH3COOH溶液,用同浓度的NaOH溶液中和时
A.两者消耗NaOH的物质的量相同
B.中和HCl消耗NaOH的物质的量多
C.中和CH3COOH消耗NaOH的物质的量多
D.两者消耗NaOH的物质的量无法比较
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某课题组设计实验探究SO2的性质。
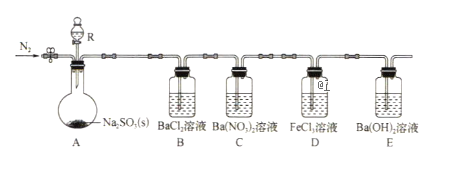
实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是__________.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:__________.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是____.
(4)探究装置C中通人SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通人过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为__________。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中, __________ | __________ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是(填字母)(_____)
A.KSCN溶液 B.NaOH溶液 C.K3[Fe(CN)6]溶液 D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH__________7(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+、Ba2 +、Cl-、SO42-B.K+、AlO2-、NO3-、OH-
C.H+、NH4+、Al3+、SO42-D.H+、Cl-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中一定正确的是( )
A.强电解质溶液的导电性比弱电解质溶液的导电性强
B.BaSO4投入水中,导电性较弱,故它是弱电解质
C.弱电解质溶液中存在两种共价化合物分子
D.氯水能导电,所以Cl2是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池的叙述中正确的是( )
A.构成原电池的两极必须是两种不同金属
B.原电池是将化学能转化为电能的装置
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于放热反应的是( )
①浓硫酸的稀释 ②工业合成氨 ③NaOH固体溶于水 ④氢氧化钡晶体与氯化铵混合 ⑤CaO溶于水 ⑥Al在高温条件下与Fe2O3的反应 ⑦酸碱中和反应
A.①②③⑤⑦B.②⑥⑦C.②⑤⑥⑦D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2等氮氧化物的消除和再利用有多种方法。
(1)活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+ CO2(g) △H = Q kJ·mol-1,在T℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.30 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
①0~10min内,N2的平均反应速率v(N2)= ___________ .
②30min后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是 ____ (填序号).
a.加入一定量的活性炭 b.改变反应体系的温度
c.缩小容器的体积 d.通入一定量的NO e.使用催化剂
(2)NH3催化还原法:原理如图所示。

①若烟气中c(NO2) :c(NO)=1 :1,发生图甲所示的脱氮反应时,每转移1.5mol电子放出的热量为113.8kJ,则发生该脱氮反应的热化学方程式为__________________.
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____________;使用Mn作催化剂时,脱氮率b-a 段呈现如图变化的可能原因是__________(答1点).
(3)直接电解吸收法:先用6%的稀硝酸吸收NOx,生成HNO2(弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,则阳极的电极反应式为________________.
(4)NO2与N2O4之间存在转化:N2O4(g) 2NO2(g),将一定量的N2O4放入恒容密闭容器中。
①己知N2O4的起始压强p0为108 kPa,325℃时,N2O4的平衡转化率为40%,则该温度下反应的平衡常数为:Kp=________kPa(用平衡分压代替平衡浓度计算,分压=总压×各物质的量分数,保留一位小数).
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-压强关系如图所示,在图标出的点中,能表示反应达到平衡状态的点为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com