
【题目】NO、NO2等氮氧化物的消除和再利用有多种方法。
(1)活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+ CO2(g) △H = Q kJ·mol-1,在T℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.30 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
①0~10min内,N2的平均反应速率v(N2)= ___________ .
②30min后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是 ____ (填序号).
a.加入一定量的活性炭 b.改变反应体系的温度
c.缩小容器的体积 d.通入一定量的NO e.使用催化剂
(2)NH3催化还原法:原理如图所示。

①若烟气中c(NO2) :c(NO)=1 :1,发生图甲所示的脱氮反应时,每转移1.5mol电子放出的热量为113.8kJ,则发生该脱氮反应的热化学方程式为__________________.
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为_____________;使用Mn作催化剂时,脱氮率b-a 段呈现如图变化的可能原因是__________(答1点).
(3)直接电解吸收法:先用6%的稀硝酸吸收NOx,生成HNO2(弱酸),再将吸收液导入电解槽中进行电解,使之转化为硝酸,则阳极的电极反应式为________________.
(4)NO2与N2O4之间存在转化:N2O4(g) 2NO2(g),将一定量的N2O4放入恒容密闭容器中。
①己知N2O4的起始压强p0为108 kPa,325℃时,N2O4的平衡转化率为40%,则该温度下反应的平衡常数为:Kp=________kPa(用平衡分压代替平衡浓度计算,分压=总压×各物质的量分数,保留一位小数).
②在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-压强关系如图所示,在图标出的点中,能表示反应达到平衡状态的点为______。

【答案】0.03 mol/(Lmin)(1分 c d 2 NH3(g) + NO(g) + NO2(g) 2N2(g) + 3H2O(g) △H = - 455.2 kJ/mol Mn、200℃左右 b~a段,随着温度升高,催化剂活性增大,反应速率增大,导致脱氮率逐渐升高 HNO2 – 2e- + H2O = 3H+ + NO3- 115.2 B点与D点
【解析】
根据速率公式v=△c/△t确定v(NO),根据速率之比就等于化学反应计量数之比确定N2的平均反应速率;根据影响化学平衡的因素知:改变固体和加催化剂不影响平衡移动;改变体系的温度,不能同时使三者的浓度都升高,即可出答案;根据转移电子数和放出的热量关系即可完成热化学反应方程式。
①由图表知0~10min内NO 的反应速率为v(NO)=(1.0-0.4)/10=0.06mol/(L![]() min),结合C(s)+2NO(g) N2(g)+ CO2(g)知N2的平均反应速率v(N2)=1/2 v(NO)=0.03 mol/(L
min),结合C(s)+2NO(g) N2(g)+ CO2(g)知N2的平均反应速率v(N2)=1/2 v(NO)=0.03 mol/(L![]() min )
min )
②由C(s)+2NO(g) N2(g)+ CO2(g) △H = Q kJ·mol-130min后,NO(g)、N2(g)、CO2(g)浓度都增大了,所以,a.加入一定量的活性炭,b.改变反应体系的温度e.使用催化剂都答不到同时使三种气体的浓度都增大;c.缩小容器的体积反应物,生成物浓度都增大, d.通入一定量的NO,使平衡正向移动, 反应重新达到平衡时各物质的浓度都增大,故答案:cd.
(2)NH3催化还原法由如图可知反应方程式为:2 NH3(g) + NO(g) + NO2(g) 2N2(g) + 3H2O(g)。此反应转移6mol电子,由已知每转移1.5mol电子放出的热量为113.8kJ。所以该脱氮反应的热化学方程式为:2 NH3(g) + NO(g) + NO2(g) 2N2(g) + 3H2O(g) △H = - 455.2 kJ/mol。
②由图乙知Mn在200℃左右时脱氮率最高,催化效果最好,脱氮率b-a 段呈现如图变化的可能原因是b~a段,随着温度升高,催化剂活性增大,反应速率增大,导致脱氮率逐渐升高。
(3)电解HNO2(弱酸),阳极上NO2-放电,生成NO3-,则阳极的电极反应式为HNO2 – 2e- + H2O = 3H+ + NO3- ;答案:HNO2 – 2e- + H2O = 3H+ + NO3-。
(4)NO2与N2O4之间存在转化: g) 2NO2(g),将一定量的N2O4放入恒容密闭容器中。
①己知N2O4的起始压强p0为108 kPa,325℃时,N2O4的平衡转化率为40%,结合三段式知平衡时各物质的压强为:P(N2O4)= kPa, = kPa则该温度下反应的平衡常数为:Kp= P2(NO2)/ P(N2O4)= 86.42/64.8=115.2 kPa。答案:115.2 kPa。
②化学平衡常数Kp= P2(NO2)/ P(N2O4),二者的反应速率之比等于其计量数之比,
所以v(NO2):v(N2O4)= k2p2(NO2):k1p(N2O4)=2:1化学平衡常数Kp= P2(NO2)/ P(N2O4)=,
则K1=1/2K2![]() KP,满足平衡条件v(NO2)=2v(N2O4)即为平衡点, B点与D点点的压强之比等于其反应速率之比为1:2,所以B点与D点为平衡点。答案:B点与D点。
KP,满足平衡条件v(NO2)=2v(N2O4)即为平衡点, B点与D点点的压强之比等于其反应速率之比为1:2,所以B点与D点为平衡点。答案:B点与D点。


科目:高中化学 来源: 题型:
【题目】体积相同、pH相同的HCl溶液和CH3COOH溶液,用同浓度的NaOH溶液中和时
A.两者消耗NaOH的物质的量相同
B.中和HCl消耗NaOH的物质的量多
C.中和CH3COOH消耗NaOH的物质的量多
D.两者消耗NaOH的物质的量无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )
A. ![]() mol/LB.
mol/LB. ![]() mol/LC.
mol/LC. ![]() mol/LD.
mol/LD. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
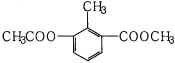
A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究有机物的方法有很多,常用的有①核磁共振氢谱②蒸馏③重结晶④萃取⑤红外光谱⑥过滤,其中用于分子结构确定的有____(填序号)。
(2)下列物质中,其核磁共振氢谱中只有一个吸收峰的是____(填字母)。
A.CH3CH3 B.CH3COOH
C.CH3COOCH3 D.CH3OCH3
(3)某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。如图是该有机物的质谱图,则其相对分子质量为______,分子式为________。
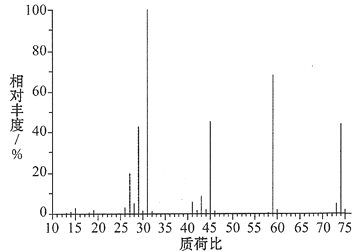
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,由分子构成但不是共价化合物的是( )
①臭氧 ② 液氨 ③葡萄糖 ④ C60 ⑤ 氖气 ⑥ 黄金 ⑦氧化铁
A. ②③④ B. ①④⑤ C. ③⑤⑥ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用煤化工所得的苯可合成甲苯、乙苯、环己烷,其反应如下:
①![]() +CH3Cl
+CH3Cl![]()
![]() (甲苯)+HCl
(甲苯)+HCl
②CH2===CH2+ (乙苯)
(乙苯)
③![]() +3H2
+3H2  (环己烷)
(环己烷)
下列说法正确的是( )
A. 反应①、②、③均属于加成反应
B. 溴水中加入苯,二者可发生取代反应
C. 甲苯中所有原子一定在同一平面上
D. 能用溴水判断反应②所得的乙苯中是否混有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中 1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是

A. a、b、c、d、e 中,c 最稳定
B. 一定温度下,Cl2 与 NaOH 溶液反应生成的产物有 a、b、d, 溶液中 a、b、d 的浓度之比可能为 11∶1∶2
C. b→a+c 反应的活化能为反应物的总能量减去生成物的总能量
D. b→a+d 反应的热化学方程式为:3ClO (aq)=ClO3- (aq)+2Cl- (aq) ΔH=+116 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com