
| n |
| V |
| m溶质 |
| m溶液 |
| ||
| 0.1L |
| 24.4g |
| 1.219g/mL×100mL |
| 1 |
| 10 |
| 1 |
| 10 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
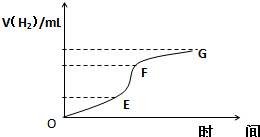 ( I)用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:
( I)用纯净的锌粒与100mL2mol/L稀盐酸反应制取氢气,请回答:| 催化剂 |
| 500℃ |
| SO2 | O2 | SO3 | |
| 反应开始时的浓度/mol?L-1 | 3.0 | 1.5 | 0 |
| 10min后的浓度/mol?L-1 | |||
| 平均反应速率/mol?L-1?min-1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.7 | B、2.0 |
| C、12.0 | D、12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液与NaHSO4溶液反应:CO32-+2H+=H2O+CO2↑ |
| B、向硫酸铵溶液中加入氢氧化钡溶液:Ba2+SO42-=BaSO4↓ |
| C、Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| D、少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com