
����Ŀ���̲��и�����Na2O2��ˮ��Ӧ�Ļ�ѧ����ʽ��ijѧϰС��ͨ��ʵ���о�Na2O2��ˮ����Ӧ����
���� | ���� |
����ʢ��4.0gNa2O2���ձ��м���50mL����ˮ | ���ҷ�Ӧ��������������ʹ������ľ����ȼ������ȫ���ܽ�õ�����ɫ��Һa |
������Һa�е������η�̪ | ��Һ��죬10���Ӻ���Һ��ɫ���Ա�dz���Ժ���Һ��Ϊ��ɫ |
������Һ�м�������MnO2��ĩ | ���д������ݲ���������������Ҳ��ʹ������ľ����ȼ |
��1��Na2O2�ĵ���ʽΪ �� �����ԣ�ʵ��֤ʵ����Һa��H2O2�Ĵ��ڣ�Ӧ��ͬλ��ʾ��ԭ�����Ա�ʾ��Ӧ�Ļ�����д��Na218O2��H2O��Ӧ�Ļ�ѧ����ʽ ��
��2���������к�ɫ��ȥ�Ŀ���ԭ���� ��
��3���÷�Ӧ2MnO4��+5H2O2+6H+=2Mn2++502��+8H2O�ⶨ��Һa��H2O2������ȡ20.00mL��Һa����ϡ���ѧʽ���ữ����0.002molL��1KMnO4��Һ�ζ������յ�ʱƽ������10.00mLKMnO4��Һ���ζ�ʱKMnO4��ҺӦװ���������ʽ�ζ����У��յ�ȷ���ķ����� �� ��������Һa��c��H2O2��=molL��1
��4������Һa�еμ�FeSO4��Һ��������Ӧ�����ӷ���ʽΪ ��
��5����FeSO4��Һ�м���һ����Na202���壬�������ʵ���Ϊ2��1������Ӧ����Ӧ�����������ɣ�д����Ӧ�����ӷ���ʽ ��
���𰸡�
��1��![]() ��2Na218O2+2H2O�T2Na18OH+2NaOH+18O2��
��2Na218O2+2H2O�T2Na18OH+2NaOH+18O2��
��2����Һa�й���H2O2���̪������Ӧ
��3��H2SO4����������һ��ʱ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��0.0025
��4��4H2O2+4Fe2++6H2O=O2��+4Fe��OH��3��+8Na+
��5��3Na2O2+6 Fe2++6H2O=6Na++4Fe��OH��3��+2Fe3+
���������⣺��1��Na2O2Ϊ���ӻ���������ʽΪ ![]() ����ʵ��֤ʵ����Һa��H2O2�Ĵ��ڣ���Na218O2��H2O��Ӧ�������������ƺ�H2O2 �� H2O2���ٷֽ�����ˮ������������Na218O2��H2O��Ӧ���ܻ�ѧ����ʽΪ2Na218O2+2H2O�T2Na18OH+2NaOH+18O2�������Դ��ǣ�
����ʵ��֤ʵ����Һa��H2O2�Ĵ��ڣ���Na218O2��H2O��Ӧ�������������ƺ�H2O2 �� H2O2���ٷֽ�����ˮ������������Na218O2��H2O��Ӧ���ܻ�ѧ����ʽΪ2Na218O2+2H2O�T2Na18OH+2NaOH+18O2�������Դ��ǣ�![]() ��2Na218O2+2H2O�T2Na18OH+2NaOH+18O2������2����ΪH2O2����ǿ������Ư�ף����Բ������к�ɫ��ȥ�Ŀ���ԭ������Һa�й���H2O2���̪������Ӧ�����Դ��ǣ���Һa�й���H2O2���̪������Ӧ����3������KMnO4��Һ������HCl��������ϡH2SO4�ữ��KMnO4��Һ����ǿ�����ԣ�Ӧװ����ʽ�ζ����У��յ�ȷ���ķ����ǵ������һ��ʱ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ������KMnO4��H2O2��Ӧ�����ӷ���ʽ��֪��ϵʽΪ��
��2Na218O2+2H2O�T2Na18OH+2NaOH+18O2������2����ΪH2O2����ǿ������Ư�ף����Բ������к�ɫ��ȥ�Ŀ���ԭ������Һa�й���H2O2���̪������Ӧ�����Դ��ǣ���Һa�й���H2O2���̪������Ӧ����3������KMnO4��Һ������HCl��������ϡH2SO4�ữ��KMnO4��Һ����ǿ�����ԣ�Ӧװ����ʽ�ζ����У��յ�ȷ���ķ����ǵ������һ��ʱ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ������KMnO4��H2O2��Ӧ�����ӷ���ʽ��֪��ϵʽΪ��
2MnO4�� | �� | 5H2O2 |
2mol | 5mol | |
0.002molL��1��0.01L | n��H2O2�� |
��n��H2O2��=5��10��5mol
����c��H2O2��= ![]() =0.0025mol/L�����Դ��ǣ�H2SO4�� � �������һ��ʱ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ�� 0.0025����4������Һa�еμ�FeSO4��Һ��Na2O2����FeSO4��Һ������Fe��OH��3�������������ӷ���ʽΪ��4Na2O2+4Fe2++6H2O=O2��+4Fe��OH��3��+8Na+�����Դ��ǣ�4Na2O2+4Fe2++6H2O=O2��+4Fe��OH��3��+8Na+����5����FeSO4��Һ�м���һ����Na202���壬�������ʵ���Ϊ2��1������Ӧ����Ӧ�����������ɣ�����Na202���������������FeSO4��Һ��������4Fe��OH��3�������ӷ���ʽΪ��3Na2O2+6 Fe2++6H2O=6Na++4Fe��OH��3��+2Fe3+ �� ���Դ��ǣ�3Na2O2+6 Fe2++6H2O=6Na++4Fe��OH��3��+2Fe3+ ��
=0.0025mol/L�����Դ��ǣ�H2SO4�� � �������һ��ʱ��Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ�� 0.0025����4������Һa�еμ�FeSO4��Һ��Na2O2����FeSO4��Һ������Fe��OH��3�������������ӷ���ʽΪ��4Na2O2+4Fe2++6H2O=O2��+4Fe��OH��3��+8Na+�����Դ��ǣ�4Na2O2+4Fe2++6H2O=O2��+4Fe��OH��3��+8Na+����5����FeSO4��Һ�м���һ����Na202���壬�������ʵ���Ϊ2��1������Ӧ����Ӧ�����������ɣ�����Na202���������������FeSO4��Һ��������4Fe��OH��3�������ӷ���ʽΪ��3Na2O2+6 Fe2++6H2O=6Na++4Fe��OH��3��+2Fe3+ �� ���Դ��ǣ�3Na2O2+6 Fe2++6H2O=6Na++4Fe��OH��3��+2Fe3+ ��


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��������ʾʵ��װ����ȡ�����������ش��������⣺ 
��1���ڴ��Թ����ȼ���3mL �� Ȼ��һ��ҡ��һ�������ؼ���2mL��2mL���ᣬ��Ͼ��ȣ�Ȼ����뼸�����Ƭ������ͼ����װ�ã��þƾ��ƶԴ��Թ�С�ľ��ȼ��ȣ����۲쵽��������ʱֹͣʵ�飮
��2�������в��õ�ʵ��װ�õIJ�֮ͬ���ǣ���λͬѧ���������θ���ܴ����˳����ܣ���������ܵ�ĩ�˲����˱���̼������Һ�У��ڴ˴����θ���ܵ����ó���ʹ�����Ҵ׳�����������
��3���мס��ҡ�����λͬѧ���ֱ�������������Ӧ�õ�������δ�ñ���Na2CO3��Һ�нӣ��ᴿ����δ��ָʾ��������£����Ƕ����ȼ�NaOH�к������ᣬȻ������������������������ǵĽ��ȴ��ͬ�� �ټõ��˲�����ˮ�������������ҵõ������Ե����Ļ����۱��õ�����ˮ�������ʣ�
���ж���λͬѧ�����NaOH�Ƕ��˻������û������ˣ������������������������������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�Ǽ������ķ������ģ�ͣ��ݴ˻ش��������⣺
��1��ͬ���ʵ�����A��B��C��Dȼ�գ������������������Ӧ��ĸ���� ͬ������A��B��C��Dȼ�գ������������������Ӧ��ĸ����
��2������ԭ�Ӷ���ͬһƽ���ϵ��������Ӧ��ĸ����
��3����ʹ���Ը��������ɫ���������Ӧ��ĸ����
��4��д��C�����ۺϷ�Ӧ�Ļ�ѧ����ʽ��
��5��д��ʵ������ȡD�Ļ�ѧ����ʽ��
��6��д��G�����ᷴӦ�Ļ�ѧ����ʽ �� 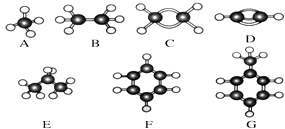
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��KI��Һ���Թ��м�������CCl4��μ���ˮ��CCl4������ɫ������������Թ��еμ���ˮ����CCl4�����dz���������ɫ��
���������գ�
��1��д������ƽCCl4������ɫ�����ɫ�Ļ�ѧ��Ӧ����ʽ�����ϵ����1��������д����++�T+
��2�����������еĻ�ԭ����
��3����KI����KBr����CCl4���Ϊɫ�������μ���ˮ��CCl4�����ɫû�б仯��Cl2��HIO3��HBrO3��������ǿ������˳���� ��
��4���ӵ����к�����Ϊ20mg��50mg/kg����ȡ�ӵ��Σ���KIO3��ʳ�Σ�1000kg����ׯKl��Cl2��Ӧ��KIO3 �� ������Ҫ����Cl2L����״��������2λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҽ�������������һ�����ʵ���Ũ����Һ��ʵ��ʱ�����õ��������ǣ���
A. �ձ� B. ������ C. ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п��һ����ɫ�뵼�壬Ҳ����Ϊ�����ѧ���ϣ��۵�1520�森
��1����̬пԭ�ӵļ۵����Ų�ʽ��
��2������Ԫ�������ɣ��縺��SeS����һ������SeAs�������������
��3��H2Se�ķ��ӹ����� �� ����Se���ӻ���������� ��
��4��H2O�ķе㣨100�棩����H2Se�ķе㣨��42�棩��ԭ���� ��
��5������ZnΪ�������ܶѻ�������λ���� ��
��6��ZnSe������ͼ�����谢��٤������ֵΪNA �� ��144gZnSe�����еľ������� �� 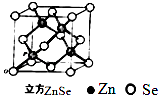
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й����������
�����кϳɲ���ش����⣺
�� | �� | �屽 | |
�ܶ�/gcm��3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
��1����a�м���15mL��ˮ����������м����b��С�ļ���4.0mLҺ̬�壮��a�е��뼸���壬�а�ɫ��������������Ϊ���������壮�����μ���Һ����꣮װ��d��������
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӣ�NaOH��Һϴ�ӵ�������
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˣ������Ȼ��Ƶ�Ŀ������
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ����Ҫ��һ���ᴿ�����в����б��������������ȷѡ��ǰ����ĸ����
A.�ؽᾧ
B.����
C.����
D.��ȡ
��4���ڸ�ʵ���У�a���ݻ����ʺϵ�����������ȷѡ��ǰ����ĸ����
A.25mL B.50mL C.250mL D.500mL
��5��д��a�з�Ӧ����Ҫ�л���ѧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼��������ֱ�Ӻϳ��Ҵ�ȼ���ѽ�����ģ������
��1�����ȡ��CO��H2Ϊԭ�Ϻϳ��Ҵ�����ѧ��Ӧ����ʽ��2CO��g��+4H2��g��CH3CH2OH��g��+H2O��g����H�����ܱ������г���10molCO��20molH2 �� �ڴ��������·�Ӧ�����Ҵ���CO��ת���ʣ��������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ�� 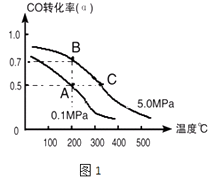
��֪��2CO��g��+O2��g���T2CO2��g����H1=��566kJmol��1
2H2��g��+O2��g���T2H2O��l����H2=��572kJmol��1
CH3CH2OH��g��+3O2��g���T2CO2��g��+3H2O��g����H3=��1366kJmol��1
H2O��g���TH2O��l����H4=��44kJmol��1
�١�H=kJmol��1
����A��C���㶼��ʾ�ﵽ��ƽ��״̬����ӷ�Ӧ��ʼ����ƽ��״̬�����ʱ��tAtC�����������������������
����A��B�����ʾ��ijʱ�̴ﵽ��ƽ��״̬����ʱ��A��ʱ���������Ϊ10L������¶��µ�ƽ�ⳣ����K=��
������̼����ȼ�ϵ�أ�MCFS��������ú����CO+H2����ȼ����������CO2�Ļ����Ϊ������ȼ������һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ��Խ�������ȼ�ϼ���Ϊ�����Ƴɵģ�������CO��Ӧ�ĵ缫��ӦʽΪ ��
��2����ҵ�ϻ����Բ�ȡ��CO2��H2Ϊԭ�Ϻϳ��Ҵ������Ҹ�����ѧ�������Ƴ磬��������ͬ�����£���CO��ȡCH3CH2OH��ƽ�ⳣ��ԶԶ������CO2��ȡCH3CH2OH ��ƽ�ⳣ�������Ʋ⻯ѧ�������Ͽ���CO2��ȡCH3CH2OH���ŵ���Ҫ�ǣ� ��
��3��Ŀǰ��ҵ��Ҳ������CO2�������״���һ�������·�����ӦCO2��g��+3H2��g��CH3OH��g��+H2O��g��������6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��������ͼ2��ʾ��ʵ�ߣ��� 
������ͼ�л���״������ʵ�����ʱ��仯���ߣ�
�ڽ��ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� �� ���ߢ��Ӧ��ʵ�������ı��� ��
��4������״����4.48L CO2ͨ��1L 0.3molL��1NaOH��Һ����ȫ��Ӧ��������Һ����Ũ�ȹ�ϵ��ȷ���� A��c��Na+��=c��HCO3����+c��CO32����+c��H2CO3��
B��c��OH����+c��CO32����=c��H2CO3��+c��H+��
C��c��Na+��+c��H+��=c��HCO3����+2c��CO32����+c��OH����
D��2c��Na+��=3c��HCO3����+3c��CO32����+3c��H2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������ѧ��Ӧ��ʹ��ˮ��ɫ������ʹ�������������Һ��ɫ����( )
��CH3CH2CH2CH3 ��CH3CH2CH===CH2

A���٢ڢۢ� B���ڢۢ�
C���ڢ� D��ֻ�Т�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com