
【题目】硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
(1)基态锌原子的价电子排布式是
(2)根据元素周期律,电负性SeS,第一电离能SeAs(填“>”或“<”)
(3)H2Se的分子构型是 , 其中Se的杂化轨道类型是 .
(4)H2O的沸点(100℃)高于H2Se的沸点(﹣42℃)其原因是 .
(5)晶体Zn为六方最密堆积,其配位数是 .
(6)ZnSe晶胞如图,假设阿伏伽德罗常数值为NA , 则144gZnSe晶体中的晶胞数是 . 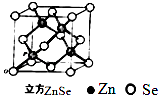
【答案】
(1)3d104s2
(2)<;<
(3)V形;sp3
(4)H2O含有氢键、H2Se不含氢键
(5)12
(6)![]()
【解析】解:(1)Zn是30号元素,其原子核外有30个电子,其3d、4s电子为其价电子,其价电子排布式为3d104s2 , 所以答案是:3d104s2;(2)同一主族元素,元素电负性随着原子序数增大而减小,所以电负性Se<S;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能Se<Sn,所以答案是:<;<;(3)H2Se价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断该分子空间构型及Se原子杂化方式分别为V形、sp3 ,
所以答案是:V形;sp3;(4)含有氢键的氢化物熔沸点较高,H2O含有氢键、H2Se不含氢键,导致H2O的沸点(100℃)高于H2Se的沸点(﹣42℃),所以答案是:H2O含有氢键、H2Se不含氢键;(5)锌单质晶体是六方最密堆积,根据锌金属的晶体结构示意图 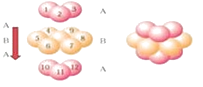
可知,原子按“ABABAB”方式堆积,晶体中Zn原子的配位数为12,所以答案是:12;(6)该晶胞中Zn原子个数为4、Se原子个数=8× ![]() +6×
+6× ![]() =4,所以该晶胞质量=(
=4,所以该晶胞质量=( ![]() )g,晶胞个数=
)g,晶胞个数= ![]() =
= ![]() ,
,
所以答案是: ![]() .
.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是______(用字母代号填).
A.FeB.FeCl3C.FeSO4D.Fe2O3
(2)向沸水中逐滴滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是______nm.
(3)检验溶液中Fe3+存在的试剂是______(填物质名称),证明Fe3+存在的现象是______.电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:______.
(4)若要验证溶液中不含Fe3+而只含有Fe2+,正确的实验操作方法及现象是______.
(5)欲从制造印刷电路板的废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
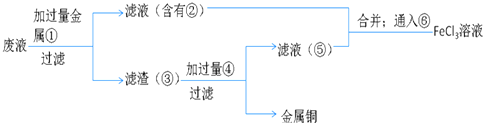
A.请写出上述实验中加入或生成的有关物质的化学式:
①______④______
B.请写出通入⑥反应的离子方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶质的质量分数为a%、物质的量浓度为c1mol/L的稀硫酸加热蒸发掉一定量的水,使质量分数为2a%,此时硫酸的物质的量浓度为c2 mol/L.已知硫酸浓度越大,密度越大,则c1 与c2的数值关系是( )
A.c1=2c2
B.c2=2cl
C.c2>2c1
D.c2<2cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有短周期X、Y、Z、M、W为五种短周期元素.其中X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L﹣1;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
A.原素Z,W的简单离子的电子层结构不同
B.Y的最高价氧化物的水化物能与其简单气态氢化物反应生成盐且显碱性
C.由X元素形成的单质不一定是原子晶体
D.由X,YCZ,M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ.向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ.向溶液a中滴入两滴酚酞 | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ.向溶液中加入少量MnO2粉末 | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 , 很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 .
(2)操作Ⅱ中红色褪去的可能原因是 .
(3)用反应2MnO4﹣+5H2O2+6H+=2Mn2++502↑+8H2O测定溶液a中H2O2含量.取20.00mL溶液a,用稀(填化学式)酸化,用0.002molL﹣1KMnO4溶液滴定,至终点时平均消耗10.00mLKMnO4溶液.滴定时KMnO4溶液应装在(填酸或碱)式滴定管中,终点确定的方法是 , 经计算溶液a中c(H2O2)=molL﹣1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为 .
(5)向FeSO4溶液中加入一定量Na202固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示.下列说法正确的是( ) 
A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32﹣向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成份为FeO.Cr2O3 , 还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠晶体(Na2Cr2O7 . 2H2O),其主要工艺流程如图: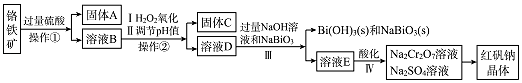
已知:NaBiO3在碱性条件下能将Cr3+氧化为CrO42﹣ .
(1)固体A为
(2)实验室中操作①②的名称为
(3)固体C中含有的物质是Al( OH)3和Fe(OH)3 , 则H2 O2的作用是 .
已知:KsP[Fe(OH)3]=3.0×10﹣39 , KsP[Al(OH)3]=1×10﹣33 , 当pH=5.6时Cr(OH)3开始沉淀.室温下,Ⅱ中需调节溶液pH范围为(杂质离子浓度小于1×10﹣6mol/L视为沉淀完全).
(4)写出Ⅲ中发生反应的离子方程式 .
(5)Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是(结合化学方程式回答);工业上也可设计如图示装置,用锂离子电池(LixC+Li1﹣xCoO2 ![]() C+LioO2 , LixC为难电离锂碳化合物)为电源,电解Na2CrO4溶液制取Na2Cr2O7 , 该装置工作时E电极的名称是极;电源的A极的电极反应式为 . 当电解过程中转移了0.5mol电子时,理论上右侧溶液的质量减少 g.
C+LioO2 , LixC为难电离锂碳化合物)为电源,电解Na2CrO4溶液制取Na2Cr2O7 , 该装置工作时E电极的名称是极;电源的A极的电极反应式为 . 当电解过程中转移了0.5mol电子时,理论上右侧溶液的质量减少 g.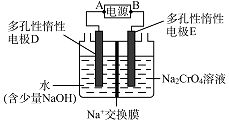
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中不存在碳碳单、双键的交替结构,下列可以作为证据的事实是( )
①苯不能使高锰酸钾酸性溶液褪色
②苯不能使溴水因发生化学反应而褪色
③苯在加热和有催化剂存在的条件下能还原成环己烷
④苯中碳碳键的键长完全相等
⑤邻二氯苯只有一种
⑥间二氯苯只有一种
A.①② B.①⑤
C.③④⑤⑥ D.①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com