
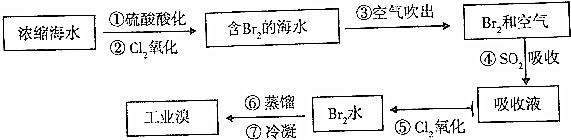
分析 苦卤中含有溴,在酸性条件下通入氯气,可发生置换反应生成溴单质,吹入空气,将溴分离出来,然后溴与二氧化硫发生反应生成HBr和硫酸,再通入氯气,生成溴,然后分液、蒸馏和得到液溴,
(1)蒸馏法是把水从水的混合物中分离出来,得到纯净的水,利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的;
(2)SO2和氯气、水反应生成硫酸和氢溴酸;
(3)步骤①②中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素;
(4)Cl2的氧化性大于Br2的氧化性,同主族元素,氯的电子层数少于溴,氯原子半径小于溴,得电子能力氯强于溴.
解答 解:苦卤中含有溴,在酸性条件下通入氯气,可发生置换反应生成溴单质,吹入空气,将溴分离出来,然后溴与二氧化硫发生反应生成HBr和硫酸,再通入氯气,生成溴,然后分液、蒸馏和得到液溴,
(1)目前淡化海水的方法有多种,如:蒸馏法、离子交换法、电渗析法等,蒸馏法是把水从水的混合物中分离出来,得到纯净的水,利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果,通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,
故答案为:bcd;
(2)SO2和氯气、水反应生成硫酸和氢溴酸,反应的离子方程式为:Br2+SO2+2H2O=2HBr+H2SO4,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)步骤①②中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)因Cl2的氧化性大于Br2的氧化性,发生Cl2+2Br-=Br2+2Cl-,同主族元素,氯的电子层数少于溴,氯原子半径小于溴,得电子能力氯强于溴.
故答案为:Cl2+2Br-=Br2+2Cl-;>;氯原子半径小于溴.
点评 本题考查了海水资源的综合利用,题目难度中等,把握流程中发生的化学反应及混合物分离方法为解答的关键,注意掌握海水资源及其综合应用方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com