
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
分析 A.甲苯与溴的四氯化碳溶液不反应;
B.结构对称,只有一种消去方式;
C.有机物A(C4H6O2)能发生加聚反应,则一定含碳碳双键;
D.已烯、四氯化碳和乙酸分别与溴水混合的现象为:溴水褪色、分层后有机层在下层、不分层.
解答 解:A.甲苯与溴的四氯化碳溶液不反应,而甲苯能使酸性高锰酸钾溶液褪色,故A错误;
B.结构对称,只有一种消去方式,则消去(分子内脱水)产物只有1种,故B错误;
C.有机物A(C4H6O2)能发生加聚反应,则一定含碳碳双键,有机物为CH2═CH-COOCH3或CH2═CHCH2COOH、CH3CH=CHCOOH,故C错误;
D.已烯、四氯化碳和乙酸分别与溴水混合的现象为:溴水褪色、分层后有机层在下层、不分层,现象不同可鉴别,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的组成、有机反应等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 理论上说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| B. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 | |
| C. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁做负极、铜做正极 | |
| D. | CaO+H2O═Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(SO2、H2O):碱石灰,洗气 | B. | 乙烷(乙烯):酸性 KMnO4,洗气 | ||
| C. | 炭粉(MnO2):热的浓盐酸,过滤 | D. | Cl2(HCl):饱和食盐水,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为:Fe-2e-═Fe2+ | B. | 电解过程中pH不变 | ||
| C. | 过程中有Fe(OH)3生成 | D. | 上述反应中Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
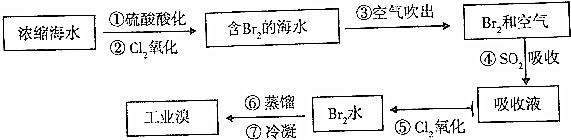
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Fe、Mg | C. | Al、Mg | D. | Zn、Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com