

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
分析 菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,加入过量浓盐酸溶解,过滤除去不溶物,滤液中含有氯化锌、氯化铁、氯化亚铁、氯化镁、氯化钙及为反应的HCl,加入漂白粉将二价铁氧化为三价铁,调节pH得到氢氧化铁沉淀,过滤分离后,再调节滤液pH得到Zn(OH)2沉淀,且不能生成Mg(OH)2.氢氧化锌用硫酸溶解,用Zn粉除去过量的硫酸,将溶液蒸发、结晶、过滤后洗涤并干燥得到晶体.
(1)根据影响化学反应速率的因素回答,固体表面积越大,反应速率越大;
(2)根据所加入物质的化学性质,根据质量守恒定律配平化学方程式;
(3)根据化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,来判断可能的组成;放电时NiO(OH)转化为Ni(OH)2,同时铝被氧化,因电解液呈碱性,则生成偏铝酸钠;
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH;
(5)从“滤液3”制取MgO过程中,应先生成Mg(OH)2;
(6)根据从溶液中制得干燥纯净的固体一般有蒸发、结晶、过滤后洗涤并干燥等操作来回答;
(7)利用关系式法来计算质量分数.
解答 解:(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分,
故答案为:增大反应物接触面积或增大反应速率或使反应更充分;
(2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子,配平书写得到离子方程式为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-,
故答案为:2,1ClO-,1H2O,2,1;
(3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH);
(4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,pH应介于8.0≤pH<10.4,
故答案为:8.0≤pH<10.4;
(5)从“滤液3”制取MgO过程中,应先生成Mg(OH)2,溶液碱性应较强,bd符合,而纯碱溶液水解呈碱性,碱性较弱,故答案为:bd;
(6)“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,
故答案为:蒸发浓缩、冷却结晶;
(7)设碳酸锌的质量为m,利用关系式法计算:
ZnCO3----ZnO
125 81
m m2
ZnCO3 的质量为m=$\frac{125m{\;}_{2}}{81}$,
ZnCO3 的质量分数为$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%,
故答案为:$\frac{125m{\;}_{2}}{81m{\;}_{1}}$×100%.
点评 本题是流行的化工工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题.能够将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题(过程:情景体现--化学视角--分解解析--问题解决).


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 煮沸水消灭水当中的细菌 | |
| B. | 加强酸或强碱对餐具进行消毒 | |
| C. | 用甲醛气体对食物进行消毒 | |
| D. | 用重金属盐消毒后加牛奶冲洗后再食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-5mol/L | B. | 1×10-12mol/L | C. | 1×10-6mol/L | D. | 1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
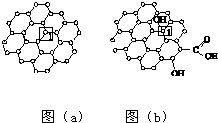 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每个水分子内含有两个氢键 | |
| B. | 只要有氢元素就能形成氢键 | |
| C. | 分子间能形成氢键使物质的熔点和沸点升高 | |
| D. | HF的稳定性很强,是因为其分子间能形成氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com