
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸或稀盐酸中,观察产生气泡的快慢,据此确定它们的活动性.该原理的离子方程式为 .
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性.试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,
并写出电极反应式.正极反应式:;负极反应式:;
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案与方案Ⅰ、Ⅱ不能雷同: , 用离子方程式表示其反应原理: .
【答案】Fe+2H+═Fe2++H2↑; ;2H++2e﹣=H2↑;Fe=Fe2++2e﹣;取无锈铁棒插入CuSO4溶液,若铁棒表面覆盖一层铜,说明Fe比Cu活动性强;Fe+Cu2+═Cu+Fe2+
;2H++2e﹣=H2↑;Fe=Fe2++2e﹣;取无锈铁棒插入CuSO4溶液,若铁棒表面覆盖一层铜,说明Fe比Cu活动性强;Fe+Cu2+═Cu+Fe2+
【解析】解:方案Ⅰ:铁与稀硫酸反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
方案Ⅱ:利用Fe、Cu作电极设计成原电池,因铁比铜活泼,负极为铁,正极为铜,电解质溶液可为酸或铜盐溶液,可设计装置图为 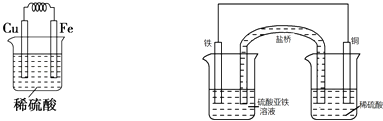 ,负极铁被氧化生成Fe2+,正极H+被还原生成H2,正极反应为2H++2e﹣→H2↑,负极反应为
,负极铁被氧化生成Fe2+,正极H+被还原生成H2,正极反应为2H++2e﹣→H2↑,负极反应为
Fe=Fe2++2e﹣,
故答案为:  ;2H++2e﹣=H2↑;Fe=Fe2++2e﹣;
;2H++2e﹣=H2↑;Fe=Fe2++2e﹣;
方案Ⅲ:根据铁和铜的置换反应设计,设计方法如下:将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的,反应原理为铁和铜离子发生氧化还原反应生成铜和二价铁离子,反应的离子方程式为Fe+Cu2+═Fe2++Cu,
故答案为:取无锈铁棒插入CuSO4溶液,若铁棒表面覆盖一层铜,说明Fe比Cu活动性强;Fe+Cu2+═Cu+Fe2+.
Ⅰ:根据铁与酸的反应分析并写出离子方程式;
Ⅱ:利用Fe、Cu作电极设计成原电池,因铁比铜活泼,负极为铁,正极为铜,电解质溶液可为酸或铜盐溶液;
Ⅲ:根据铁、铜之间的置换反应设计.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

A. 用装置甲制取一氯甲烷
B. 用装置乙在实验室制取氨气
C. 用装置丙萃取溴水中的溴
D. 用装置丁在实验室制蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( ) 
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法正确的是
A.冰融化成水放出热量
B.化学键断裂过程一定放出能量
C.生成物的总能量一定低于反应物的总能量
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+ ![]() O2(g)=
O2(g)= ![]() N2(g)+H2O(l)△H=+267kJmol﹣1
N2(g)+H2O(l)△H=+267kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,如图烧杯中各盛有50mL的溶液. 
(1)甲溶液PH=;
(2)若将甲溶液全部倒入乙中,所得的混合溶液的PH丙溶液的PH(填“>”、“<”或“=”).
(3)若将乙溶液全部倒入丙中,所得的混合溶液PH>7,所得溶液中离子浓度大小顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sn 元素位于元素周期表第IVA 族,SnCl4可用作媒染剂和催化剂,工业上常用氯气与金属锡在300℃反应制备SnCl4。SnCl4 极易水解,SnCl2、SnCl4的一些物理数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 232 | 2260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
用下列装置合成四氯化锡(夹持装置略)。注:在仪器3 中各加入0.6 mL浓硫酸,实验操作如下:
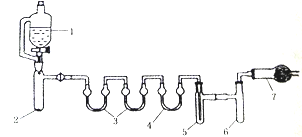
I.把干燥的仪器按图示装置连接好,在仪器1中加入B mL浓盐酸,在仪器2中加入2.0g KMnO4,在仪器5中加入2~3颗Sn粒;
II.打开活塞,让盐酸流下,均匀产生Cl2并充满整套装置,然后加热Sn粒,将生成的SnCl4收集在仪器6中;
III.Sn粒反应完毕后,停止加热,同时停止滴加盐酸,取下仪器6,迅速盖好盖子。
请回答:
(1)写出仪券2中发生化学反应方程式________________________。
(2)下列说法不正确的是______。
A.装置连接好,加入药品前要检查装置的气密性
B.产生的Cl2先充满整套装置,这步操作不可以省略
C.操作中应控制盐酸的滴入速率,不能太快,也不能太慢
D.仪器6 可用冰水浴冷却,也可以自然冷却
(3)仪器7 放的试剂是_______________________,作用是___________________、__________________。
(4)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到___________________现象,化学方程式为___________________________________。
(5)经测定产品中含有少量的SnCl2,可能的原因___________( 用化学方程式表示)。
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.400 g产品溶于50 mL的稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液8.00 mL,反应原理为:3SnCl2+ KIO3+ 6HCl==3SnCl4+ KI+ 3H2O,判断滴定终点的依据为______________________________,产品的纯 度为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com