
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
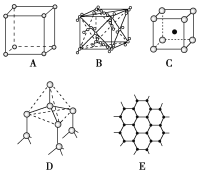
请回答下列问题:
(1)代表金刚石的是________(填编号字母,下同),其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
【答案】D 4 原子 E 2 A 12 C 离子 8 B 分子 12
【解析】
根据不同物质晶体的结构特点来辨别图形所代表的物质。NaCl晶胞是简单的立方单元,干冰也是立方体结构,但在立方体每个正方形面的中央都有一个CO2分子,称为“面心立方”,金刚石的基本单元是正四面体,为空间网状结构,石墨是分层结构。
(1)在金刚石晶胞中,每个碳原子可与周围4个碳原子形成共价键,将这4个碳原子连接起来后可以形成正四面体,体心是1个碳原子,所以图D为金刚石,每个碳原子与4个碳原子最近且距离相等,金刚石是空间网状结构,属于原子晶体,故答案为:D,4,原子。
(2)石墨是平面层状结构,在层与层之间以范德华力相互结合,在层内碳与碳以共价键相互作用,形成六边形,所以图E为石墨的结构,每个碳原子紧邻另外3个碳原子,即每个六边形占有1个碳原子的1/3,所以大的结构中每个六边形占有的碳原子数是6×1/3=2个,故答案为:E,2。
(3)在氯化钠晶胞中,每个Na+周围有6个Cl-,每个Cl-周围也有6个Na+,所以图A为氯化钠的结构,根据晶胞的结构,每个钠离子周围距离最近的钠离子在小立方体的面对角线的位置,每个钠离子周围有8个这样的立方体,所以每个钠离子周围与它最近且距离相等的钠离子就有12个,故答案为:A,12。
(4)CsCl的晶胞中铯离子与氯离子的配位数都是8,即每个铯离子周围有8个氯离子,每个氯离子周围有8个铯离子,所以,图C为CsCl的结构,属于离子晶体,故答案为:C,离子,8。
(5)干冰也是分子晶体,CO2位于立方体的面心和顶点上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在于该顶点相连的12个面的面心上,所以图B为干冰晶体,故答案为:B,分子,12。


科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,发生反应N2+3H2![]() 2NH3△H<0,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是( )
2NH3△H<0,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是( )
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1>Q2
B.N2的转化率:I>Ⅲ
C.平衡时H2的浓度:I>Ⅲ
D.平衡时氨气的体积分数:I>II
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为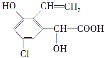 ,下列关于该有机物的说法中不正确的是
,下列关于该有机物的说法中不正确的是
A. 遇FeCl3溶液显紫色
B. 与足量的氢氧化钠溶液在一定条件下反应,最多消耗NaOH 3 mol
C. 能发生缩聚反应和加聚反应
D. 1 mol该有机物与浓溴水反应,最多消耗3 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究原电池产生电流的过程,设计了如图所示实验:
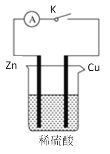
(1)下列叙述中正确的是___。
A.打开开关K时铜片作负极,关闭开关K时铜片作正极
B.打开开关K,锌片和铜片上均有气泡产生
C.关闭开关K后,溶液中的H+浓度减小
D.关闭开关K产生气泡的速率比打开开关K时慢
(2)打开开关K后,装置中发生反应的离子方程式为___。
(3)关闭开关K后,则该装置为___(填“原电池”或“电解池”),锌极为___极(填“正”、“负”、“阳”或“阴”),铜极上的电极反应式为__。若反应过程中有0.3mol的电子发生转移,则产生的气体在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与碳元素同周期的核外电子排布中有 3 个未成对电子的元素在第二周期________族, 该元素的气态氢化物的电子式为_______,其空间构型是______,是含________共价键的____分子(填极性或非极性)。该气体溶于水后,水溶液呈_____性(填“酸”或“碱”)原因是____(用方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1。由图中可以看出,该同学在操作时的一个错误是___,烧杯的实际质量为____g。
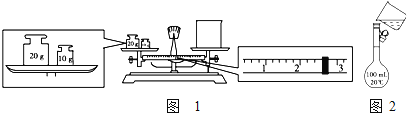
(2)需配制250mL0.2molL-1氯化钠溶液,图2是该同学转移溶液的示意图。指出上面图2中存在的两个错误:①____②____。
(3)用质量分数为98%密度为1.84gcm-3的浓硫酸配制1000mL0.1mol·L-1稀硫酸。
①应用量筒量取浓硫酸____mL。
②配制硫酸溶液时需要用到的仪器有___、____、___、___(除量筒外,写出其余四种)。
③下列操作结果,使所配制溶液物质的量浓度偏高的是____。
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.定容时俯视刻度线
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
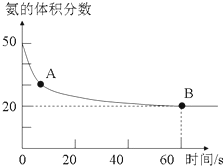
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现 将体积比为2∶1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)![]() NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
①上述反应的焓变:ΔH__0,熵变ΔS__0(填“>”“<”或“=”)。
②下列说法能说明上述反应建立化学平衡状态的是_______。
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化 D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=_____(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com