
【题目】与碳元素同周期的核外电子排布中有 3 个未成对电子的元素在第二周期________族, 该元素的气态氢化物的电子式为_______,其空间构型是______,是含________共价键的____分子(填极性或非极性)。该气体溶于水后,水溶液呈_____性(填“酸”或“碱”)原因是____(用方程式表示)
【答案】ⅤA ![]() 三角锥型 极性 极性 碱 NH3·H2ONH4+ + OH-
三角锥型 极性 极性 碱 NH3·H2ONH4+ + OH-
【解析】
与碳元素同周期的核外电子排布中有 3 个未成对电子,该元素核外电子排布式为1s22s22p3,该元素为氮,第二周期ⅤA族, 氮元素的气态氢化物为氨气(NH3)其电子式为![]() ,中心原子为sp3杂化,其空间构型是三角锥型,NH3中N和H两种不同元素构成极性共价键,由于氮元素存在孤对电子,对成键电子的排斥作用较强,N-H之间的键角小于109°28′,正负电荷重心不重合,形成极性分子;NH3溶于水后,与水反应生成一水合氨,一水合氨是弱碱在水中部分电离产生氢氧根离子和铵根离子,电离方程式为:NH3·H2ONH4+ + OH-,水溶液呈碱性;
,中心原子为sp3杂化,其空间构型是三角锥型,NH3中N和H两种不同元素构成极性共价键,由于氮元素存在孤对电子,对成键电子的排斥作用较强,N-H之间的键角小于109°28′,正负电荷重心不重合,形成极性分子;NH3溶于水后,与水反应生成一水合氨,一水合氨是弱碱在水中部分电离产生氢氧根离子和铵根离子,电离方程式为:NH3·H2ONH4+ + OH-,水溶液呈碱性;
答案为:ⅤA;![]() ;三角锥型;极性;极性;碱;NH3·H2ONH4+ + OH-。
;三角锥型;极性;极性;碱;NH3·H2ONH4+ + OH-。


科目:高中化学 来源: 题型:
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。实验室用大理石(主要成分为CaCO3,另外有少量的含硫化合物)和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
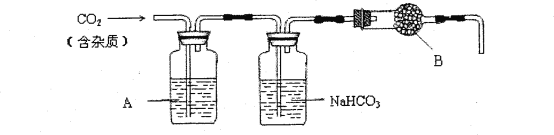
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L—1),应选用的仪器是____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
上述装置中,A是___溶液,NaHCO3溶液可以吸收____。上述装置中,B物质是____。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。
(2)SiO2与CO2组成相似,但固体的熔点相差甚大,其原因是_____。
(3)饱和的Na2CO3溶液中通入过量CO2的离子方程式为_____。0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=_____,其中有关碳微粒的关系为:____ =0.1mol/L。浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中离子浓度由大到小的关系为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
A.v(A)=0.2mol/(Ls)B.v(B)=0.6mol/(Ls)
C.v(C)=0.3mol/(Ls)D.v(D)=0.5mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O),俗称大苏打,是无色透明晶体,易溶于水,易被氧化。是一种重要的化工产品,临床上用于氰化物的解毒剂,工业上也用于纸浆漂白的脱氯剂。某兴趣小组在实验室用如下装置(夹持仪器略去)模拟硫代硫酸钠生产过程。

(1)仪器a的名称为_________。
(2)装置A中发生反应的化学方程式为_____________________________。
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2CO3恰好完全反应,则烧瓶C中Na2S和Na2CO3物质的量之比为____________。
(4)装置B中盛有饱和NaHSO3溶液,装置B的作用是_________、__________。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为____(填序号)。

(6)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
已知:Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。
限选试剂:稀HNO3、稀H2SO4、稀HCl、蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
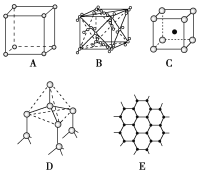
请回答下列问题:
(1)代表金刚石的是________(填编号字母,下同),其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
A. v(A2)=0.008 mol·L-1·s-1B. v(A2)=0.3 mol·L-1·min-1
C. v(AB3)=0.01 mol·L-1·s-1D. v(B2)=0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s) ![]() B+C(g) △H=-Q kJ·mol-1 达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) △H=-Q kJ·mol-1 达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A. 产物B的状态只能为固态或液态
B. 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 保持体积不变,向平衡体系中加入B,平衡一定向逆反应方向移动
D. 若开始时向容器中加入1 mol B和1 mol C,达到平衡时吸收热量QkJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com