
【题目】化学与生活生产密切相关。下列说法中错误的是
A.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B.钡中毒患者可尽快使用苏打溶液洗胃,将Ba2+转化为BaCO3而排出
C.夏天冰箱保鲜食品的原理是降低温度,减慢化学反应速率
D.纯碱溶液显碱性,加热去油污效果更佳。
【答案】B
【解析】
A.![]() 能与
能与![]() 发生双水解反应生成气体,铵态氮肥与草木灰一起使用会使肥料失去作用,因此不能混合使用,故A不符合题意;
发生双水解反应生成气体,铵态氮肥与草木灰一起使用会使肥料失去作用,因此不能混合使用,故A不符合题意;
B.重金属中毒患者可饮用大量牛奶,利用蛋白质变性消耗重金属离子缓解中毒作用并及时就医,胃液中含有大量盐酸,会与碳酸钠反应,不能达到除去重金属离子的目的,且苏打的碱性较强,一般不能直接服用,故B符合题意;
C.温度降低能够降低化学反应速率,冰箱保鲜食品的原理是通过降低温度从而降低食物氧化速率,故C不符合题意;
D.纯碱为碳酸钠,属于强碱弱酸盐,能够发生水解使溶液呈碱性,能够使油污发生碱性水解,加热能够促进水解,从而提高除污能力,故D不符合题意;
故答案为:B。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】化合物M(C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:

已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+ 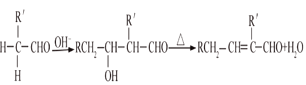 。请回答下列问题:
。请回答下列问题:
(1)K的名称是___________;G中含有的官能团名称是______________。
(2)写出D→E的化学方程式____________________________________。
(3)A→B的反应类型是_______;
(4)同时满足下列三个条件的K的同分异构体有_____种(不考虑立体异构)。①遇FeCl3溶液发生显色反应;②能发生银镜反应;③除苯环以外不再含有其他环状结构。其中核磁共振氢谱为五组峰的结构简式为____。
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是_____(填元素符号),e的价层电子轨道表示式为____。
(2)a和其他元素形成的二元共价化合物中,三角锥形分子的中心原子的杂化方式为____。
(3)这些元素形成的含氧酸中,HNO2、H2SO3的中心原子价层电子对数之和为____,H2SO3和H2SO4酸根的空间构型分别为____、____。
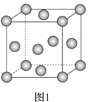
(4)e单质晶体结构如图1,此晶胞模型名称为____,e原子半径为r cm,e的相对原子质量为M,晶胞密度为ρ g/cm3,则阿伏加德罗常数为_____mol-1(用r、ρ表示)。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。
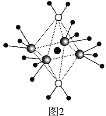
该化合物中,阴离子为____,阳离子中存在的化学键类型有______;该化合物加热时首先失去的组分是______(填“H2O”或“NH3”),判断理由是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,关于pH=11的NH3·H2O溶液,下列分析正确的是
A. c(NH3·H2O)=10-3mol/L
B. 由水电离出的c(H+)=10-11 mol/L
C. 加入少量 NH4Cl固体,NH3·H2O的电离平衡逆向移动,KW值减小
D. 加入等体积 pH=3的盐酸,所得溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在![]() =106mol/L的溶液中Al3+、NH4+、Cl-、SO42-
=106mol/L的溶液中Al3+、NH4+、Cl-、SO42-
B.由水电离的的c(H+)=10-13mol/L溶液中Ca2+、K+、Cl-、HCO3-
C.pH=1的溶液中:Fe2+、Na+、SO42-、NO3-
D.使酚酞呈红色的溶液;Mg2+、ClO-、AlO2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
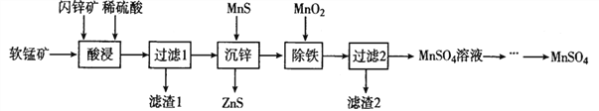
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒中的新药。合成丁苯酞(J)的一种路线如图所示:
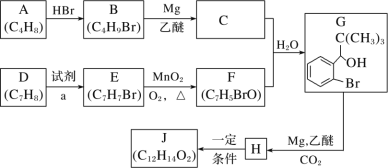
已知:
(1)B 的化学名称是_____,F 中含氧官能团名称是_____。
(2)由 E 生成 F 和 H 生成J 的反应类型分别是_____、_____。
(3)试剂 a 是_____。
(4)J 是一种环酯,则J 的结构简式为_____。H 在一定条件下还能生成高分子化合物 K,H 生成K 的化学方程式为:_____________________。
(5)M 的组成比 F 多 1 个 CH2 基团,M 的分子式为 C8H7BrO,M 的同分异构体①能发生银镜反应;②含有苯环;③不含甲基。满足上述条件的M 的同分异构体共有_____种。
(6)利用题中信息写出以乙醛和苯为原料,合成![]() 的流程图(其他试剂自选)。______________
的流程图(其他试剂自选)。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com