
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1的盐酸滴定20 mL约0.1 mol·L-1的氨水,滴定曲线如图所示,下列说法正确的是( )
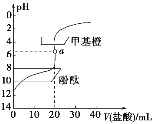
A.a点溶液中:c(H+)=c(OH-)+c(NH3·H2O)
B.滴定过程中,当溶液pH=7时,二者恰好中和
C.用酚酞作指示剂比用甲基橙作指示剂滴定误差更小
D.当滴入盐酸为30mL时,溶液中:c(H+)+c(NH4+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =__________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质间可能包括多步反应,其总的离子方程式正确的是 ( )
A. 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O===HClO+HSO3-
B. 向FeBr2溶液中通入少量Cl2:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 向 AlCl3溶液中投入过量Na:Al3++4Na+2H2O===AlO2-+4Na++2H2↑
D. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO![]() +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。查阅资料知SO3的熔点为16.83℃,沸点是44.8℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
2SO3(g) ΔH<0。查阅资料知SO3的熔点为16.83℃,沸点是44.8℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。

请根据要求回答问题:
(1)各装置接口的连接顺序是a→__。
(2)装置Ⅳ烧杯中盛放冰水的作用是__。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是__。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是__。
(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活生产密切相关。下列说法中错误的是
A.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B.钡中毒患者可尽快使用苏打溶液洗胃,将Ba2+转化为BaCO3而排出
C.夏天冰箱保鲜食品的原理是降低温度,减慢化学反应速率
D.纯碱溶液显碱性,加热去油污效果更佳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B.室温下,pH=3的NH4Cl溶液中,由水电离的OH-浓度为10-11mol/L
C.12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
D.常温下,1mol/LFe2(SO4)3溶液中,Fe3+和SO42-的离子总数是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol/LCH3COOH溶液中加入少量水,溶液中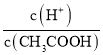 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中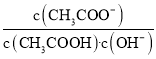 增大
增大
C.向盐酸中加入氨水至中性,溶液中c(NH4+):c(Cl-)>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中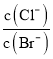 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的五种短周期元素,且
是原子序数依次增大的五种短周期元素,且![]() 是元素周期表中原子半径最小元素,
是元素周期表中原子半径最小元素,![]() 、
、![]() 相邻,
相邻,![]() 元素可以与
元素可以与![]() 、
、![]() 、
、![]() 元素分别形成甲、乙、丙三种物质,且甲、乙均为10电子化合物,丙为18电子双原子化合物。
元素分别形成甲、乙、丙三种物质,且甲、乙均为10电子化合物,丙为18电子双原子化合物。![]() 元素原子的最外层电子数与核外电子层数相等。已知:甲+丙→丁。下列说法正确的是
元素原子的最外层电子数与核外电子层数相等。已知:甲+丙→丁。下列说法正确的是
A.简单离子半径:![]()
B.![]() 与
与![]() 两种元素共同形成的10电子微粒有3种
两种元素共同形成的10电子微粒有3种
C.![]() 元素在元素周期表中的位置是第二周期第ⅡA族
元素在元素周期表中的位置是第二周期第ⅡA族
D.丁物质由非金属元素组成,只含共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com