
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |


科目:高中化学 来源: 题型:
| 选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
| A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
| B | HCl溶液 | 氨水 | 酚酞 | 浅红色→无色 |
| C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
| D | 碘水 | Na2S溶液 | 淀粉 | 无色→蓝色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
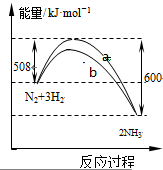
| A、加入催化剂可增大正反应速率,降低逆反应速率 |
| B、正反应的活化能大于逆反应的活化能 |
| C、b曲线是未加入催化剂时的能量变化曲线 |
| D、该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| B、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C、洗净的锥形瓶和滴定管可以放进烘箱中烘干 |
| D、氢氟酸试剂和NaOH溶液不可用带玻璃塞的玻璃瓶存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Cl-)=3.0 mol?L-1 |
| C、c(Fe2+):c(Cu2+)=1:1 |
| D、c(Fe2+):c(Fe3+)=3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com