
【题目】下列说法不正确的是( )
A. 化学反应中一定有化学键断裂,同时也有化学键形成
B. 含有共价键的化合物必定是共价化合物
C. 含有离子键的化合物必定是离子化合物
D. 金属元素和非金属元素形成的化合物不一定是离子化合物
科目:高中化学 来源: 题型:
【题目】某有机物的质量为3.0g,完全燃烧后产物通过浓硫酸,浓硫酸质量增加3.6g;其余的气体再通过碱石灰,被完全吸收,碱石灰质量增加6.6g。已知该有机物的蒸气对氢气的相对密度是30。
(1)求该有机物的分子式。(要求写计算过程)
(2)若该有机物能与金属钠反应,经催化氧化后的生成物含有醛基,请写出该有机物的结构简式,并对它进行命名。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①需要加热方能发生的反应一定是吸热反应
②化学反应的发生一定会伴随能量变化
③反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
④旧化学键的断裂说明-一定发生了化学反应
A. ③④ B. ①② C. ②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性I->Fe2+>I2,在水溶液中I2可被Cl2氧化为IO![]() 。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的是( )
。向含溶质a mol的FeI2溶液中通入b mol Cl2,充分反应(不考虑单质与水的反应)。下列说法不正确的是( )
A. 当a=2b时,反应后的离子浓度之比c(Fe2+)∶c(I-)∶c(Cl-)=1∶1∶1
B. 当3a=2b时,发生的离子反应:2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl-
C. 当13a=2b时,发生的离子反应为2Fe2++4I-+13Cl2+12H2O===4IO![]() +26Cl-+2Fe3++24H+
+26Cl-+2Fe3++24H+
D. 若反应后溶液中I2与IO![]() 的物质的量之比为1∶1,则反应中转移电子3.5b mol
的物质的量之比为1∶1,则反应中转移电子3.5b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列实验事实所引出的相应结论正确的是 ( )
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
C | 物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含x mol NH4Fe(SO4)2的溶液中逐滴加入y mol Ba(OH)2溶液,下列说法正确的是( )
A. 当x=2y时,发生的离子反应为2NH![]() +SO
+SO![]() +Ba2++2OH-===2NH3·H2O+BaSO4↓
+Ba2++2OH-===2NH3·H2O+BaSO4↓
B. 当x≥y时,发生的离子反应为2Fe3++3SO![]() +3 Ba2++6OH-===2Fe(OH)3↓+3BaSO4↓
+3 Ba2++6OH-===2Fe(OH)3↓+3BaSO4↓
C. 当2x=y时,发生的离子反应为2Fe3++2NH![]() +2SO
+2SO![]() +2Ba2++6OH-===2Fe(OH)3↓+2BaSO4↓+2NH3·H2O
+2Ba2++6OH-===2Fe(OH)3↓+2BaSO4↓+2NH3·H2O
D. 当x<y<1.5x时,沉淀质量为(233x+107×![]() ) g
) g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S)
B. 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
C. 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+) = c(CH3COOH) > c(CH3COO-) > c(H+) = c(OH-)
D. 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中![]() 的值减小到原来的
的值减小到原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
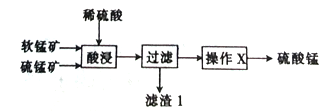
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com